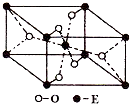
摘要:4.已知A.B.C.D.E五种元素的核电荷数依次增大.除E为第四周期元素外.其余都 是短周期元素.其中A.B.C是同一周期的非金属元素.A元素最外层电子数是内层电子数的2倍.B元素基态原子的最外层有3个未成对电子.化合物DC的晶体为离子晶体.D的二价阳离子与C的阴离子具有相同的电子层结构.E元素的+3价离子的3d能级为半充满状态.(答题时用ABCDE对应的元素符号表示) (1)A的氢化物A2H2分子的空间构型为 .其中心原子采取的杂化形式为 .分子中含有 个键. π键. (2)写出化合物DC的电子式 .E原子的核外电子排布式 . (3)由E元素形成的金属的晶胞结构如右图.则该晶胞中含有金属原子的数目为 . 5常温下为液态.熔点为-20.5℃.沸点为103℃. 易溶于非极性溶剂.据此判断E(CO)5晶体属于 (填晶 体类型).
网址:http://m.1010jiajiao.com/timu3_id_83923[举报]
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):(1)元素B、C的第一电离能的大小关系是
N>O
N>O
.(2)A的氢化物:A2H4分子中,A原子采取的杂化形式为
sp2杂化
sp2杂化
,分子中含有5
5
个σ键和1
1
个π键,键角是1200
1200
.(3)单质D和铝的混合粉末mg,与足量氢氧化钠浓溶液充分反应,生成标准状况下气体的体积为VL,则混合粉末中单质D的质量百分数是
m-
| ||
| m |
m-
| ||
| m |
(4)由E元素形成的金属的晶胞结构如图,则该晶胞中含有金属原子的数目为
2
2
,已知该晶胞中E元素的相对原子质量为Mg/mol,任意两个相邻距离最近E的核间距为acm,这种金属的密度是| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
3d24s2
3d24s2
.(2)由A、B、C形成的ABC分子中,含有
2
2
个σ键,2
2
个π键;(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为
TiO2
TiO2
,该晶体中氧原子的配位数为3
3
.(4)B、C、D三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为
[TiCl(H2O)5]2+
[TiCl(H2O)5]2+
. 已知A、B、C、D、E五种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子.(1)已知E元素的原子序数是D元素的3倍,则E基态原子的电子排布式为
[Ar]3d54s1
[Ar]3d54s1
.(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
C<O<N
C<O<N
(填元素符号).(3)1mol B2A2分子中含σ键的数目是
3NA
3NA
.(4)BD2在高温高压下所形成的晶体其晶胞如图所示.该晶体的类型属于
原子
原子
(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为sp3
sp3
. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:(1)化合物M的结构简式为
HCHO
HCHO
.(2)在元素周期表中,E元素位于第
四
四
周期Ⅷ
Ⅷ
族.用电子排布式写出E元素基态原子的价电子构型3d64s2
3d64s2
.(3)元素C与D的第一电离能的大小关系是C
>
>
D(填“>”、“<”或“=”).(4)在一密闭容器中发生反应2CD2(g)?2CD(g)+D2(g)△H>O,反应过程中CD2的浓度随时间变化的情况如图所示.
①依曲线A,反应在3min内D2的平均反应速率为
0.0117mol/(L?min)
0.0117mol/(L?min)
.②若曲线A、B分别表示该反应在某不同条件下的反应情况,则此条件是
温度
温度
(填“浓度”、“压强”、“温度”或“催化剂”).③曲线A、B分别对应的反应平衡常数大小关系是KA
<
<
KB(填“>”、“<”或“=”)(5)甲同学用图1所示装置对E元素单质与浓硫酸的反应进行实验.①检查装置气密性后,将过量的E元素单质和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时.t1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.在0~t1时间段,E表面没有气泡生成,说明E在浓硫酸中发生了
钝化
钝化
;t1~t2时间段,反应生成的气体是SO2、H2
SO2、H2
.写出开始加热时发生反应的化学方程式2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O
| ||
2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O
.
| ||

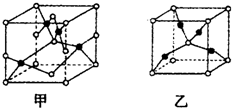 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. 请填写下列空白.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. 请填写下列空白.(1)E元素基态原子的核外电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为