题目内容
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):(1)元素B、C的第一电离能的大小关系是
N>O
N>O
.(2)A的氢化物:A2H4分子中,A原子采取的杂化形式为
sp2杂化
sp2杂化
,分子中含有5
5
个σ键和1
1
个π键,键角是1200
1200
.(3)单质D和铝的混合粉末mg,与足量氢氧化钠浓溶液充分反应,生成标准状况下气体的体积为VL,则混合粉末中单质D的质量百分数是
m-
| ||
| m |
m-
| ||
| m |
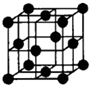
(4)由E元素形成的金属的晶胞结构如图,则该晶胞中含有金属原子的数目为
2
2
,已知该晶胞中E元素的相对原子质量为Mg/mol,任意两个相邻距离最近E的核间距为acm,这种金属的密度是| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
分析:A元素最外层电子数是内层电子数的2倍,则A应为C元素,A、B、C是同一周期的非金属元素,则为第二周期元素,B元素基态原子的最外层有3个未成对电子,其电子排布为1S22S22P3,应为N元素,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,则C为第二周期第ⅥA族元素,应为O元素,D为第三周期第ⅡA组元素,应为Mg元素,E元素的+3价离子的3d能级为半充满状态,则E的元素序数应为23+3=26,为Fe元素,以此解答题中各小问.
解答:解:A元素最外层电子数是内层电子数的2倍,则A应为C元素,A、B、C是同一周期的非金属元素,则为第二周期元素,B元素基态原子的最外层有3个未成对电子,其电子排布为1S22S22P3,应为N元素,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,则C为第二周期第ⅥA族元素,应为O元素,D为第三周期第ⅡA组元素,应为Mg元素,E元素的+3价离子的3d能级为半充满状态,则E的元素序数应为23+3=26,为Fe元素,
(1)B为N元素,C为O元素,N原子p轨道为半充满状态,结构稳定,难以失去电子,第一电离能较大,故N>O,故答案为:N>O;
(2)A的氢化物为C2H4,C形成3个δ键,为sp2杂化,分子中含有5个δ键,1个π键,键角为1200,
故答案为:sp2杂化;5;1;1200;
(3)单质镁和铝的混合粉末mg,与足量氢氧化钠浓溶液充分反应,生成标准状况下气体的体积为VL,
因镁和氢氧化钠不反应,铝与氢氧化钠发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=
mol,则n(Al)=
mol,
m(Al)=
mol×27g/mol=
g,
则m(Mg)=(m-
)g
则混合粉末中单质D的质量百分数是
×100%,
故答案为:
×100%;
(4)根据均摊法计算,晶胞中含有金属原子的数目为1+8×
=2,
一个晶胞中的质量为
,一个立方氮化硼晶胞的体积是(acm)3,因此立方氮化硼的密度是
g?cm-3,故答案为:2;
g?cm-3.
(1)B为N元素,C为O元素,N原子p轨道为半充满状态,结构稳定,难以失去电子,第一电离能较大,故N>O,故答案为:N>O;
(2)A的氢化物为C2H4,C形成3个δ键,为sp2杂化,分子中含有5个δ键,1个π键,键角为1200,
故答案为:sp2杂化;5;1;1200;
(3)单质镁和铝的混合粉末mg,与足量氢氧化钠浓溶液充分反应,生成标准状况下气体的体积为VL,
因镁和氢氧化钠不反应,铝与氢氧化钠发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=
| V |
| 22.4 |
| 2V |
| 3×22.4 |
m(Al)=
| 2V |
| 3×22.4 |
| 18V |
| 22.4 |
则m(Mg)=(m-
| 18V |
| 22.4 |
则混合粉末中单质D的质量百分数是
m-
| ||
| m |
故答案为:
m-
| ||
| m |
(4)根据均摊法计算,晶胞中含有金属原子的数目为1+8×
| 1 |
| 8 |
一个晶胞中的质量为
| 2M |
| NA |
| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
点评:本题考查原子结构与元素周期律的关系,题目较为综合,涉及分子的立体构型、共价键类型、杂化类型的判断、电子式以及晶胞等知识,题目难度中等,本题注意正确推断元素的种类是解答该题的关键.

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: