摘要:6.下列说法或表示方法正确的是 ( ) A.反应物的总能量低于生成物的总能量时.该反应一定不能发生 B.强酸跟强碱反应放出的热量一定是中和热 C.由石墨比金刚石稳定可知:C ΔH<0 D.在101 kPa.25℃时.2 g H2完全燃烧生成液态水.放出285.8 kJ热量.则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol 解析:反应物的总能量低于生成物的总能量时.可以通过吸热使反应发生,强酸与强碱反应放出的热量不一定为中和热.如浓硫酸反应过程中首先溶于水要放热.使热量的数值大于中和热.所以B项错,对于D选项.因为2 g H2相当于1 mol.故所写的热化学方程式中放出的热量应为571.6 kJ.故ΔH=-571.6 kJ/mol,由石墨比金刚石稳定可知石墨的能量应比金刚石低.则由金刚石转化成石墨应该放热.故本题的正确答案为C. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_83912[举报]
下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol
C.已知:2SO2 (g) +
O2 (g) 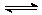 2SO3
(g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3
(g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0
查看习题详情和答案>>
下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol
C.已知:2SO2 (g) + O2
(g) 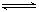 2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0
查看习题详情和答案>>
下列说法或表示方法正确的是
| A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol |
C.已知:2SO2 (g) + O2 (g) 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 |
| D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0 |
 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量