摘要:12.下列说法正确的是 ( ) A.油脂都不能使溴的四氯化碳溶液褪色 B.棉花.蚕丝和人造毛的主要成分都是纤维素 C.无论是乙烯的加成反应.还是乙烯使酸性KMnO4溶液褪色.都与分子内含有碳碳双键有关 D.所有烷烃和糖类中都存在碳碳单键 解析:选项A.不饱和油脂中含有不饱和的碳碳双键.能使溴的四氯化碳溶液褪色.选项B.棉花的主要成分是纤维素.蚕丝的主要成分是蛋白质.人造毛的主要成分是合成纤维.选项C.碳碳双键是乙烯的官能团.乙烯的加成.氧化等反应都是由碳碳双键所引起的.选项D.CH4分子中不存在碳碳单键. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_83691[举报]
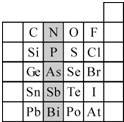 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.①写出元素符号:A
H
H
,CS
S
,EK
K
.②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.③用电子式表示C与E形成E2C的过程:


(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
①阴影部分元素N在元素周期表中的位置为第
二
二
周期第ⅤA
ⅤA
族.根据元素周期律,预测:酸性强弱 H3AsO4
<
<
H3PO4.(用“>”或“<”表示)②元素S的最高正价和最低负价的代数和为
+4
+4
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度更小
更小
.(选填“更大”、“更小”或“相同”)③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
Br-、SO42-、H+
Br-、SO42-、H+
.④下列说法正确的是
A、B、D
A、B、D
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
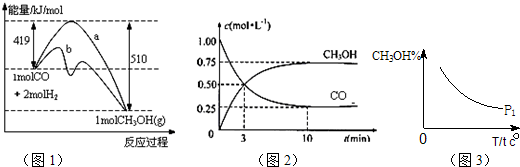
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应.
(2)下列说法正确的是
A.该反应的反应热为:△H=91kJ?mol-1
B.起始充入的CO为2mol
C.容器中压强恒定时,反应已达平衡状态
D.增加CO浓度,CO的转化率增大
E.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)= ;请在“图3”中画出甲醇百分含量随温度T变化的P2曲线,且P1<P2.
(4)以甲醇、空气为主要原料,KOH溶液为电解质溶液,铂为电极构成燃料电池.则该电池中负极上的电极反应式为 .
(5)已知在常温常压下:
①H2O(g)=H2O(l)△H1=-44.0kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H3=-1275.6kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
查看习题详情和答案>>

请回答下列问题:
(1)在“图1”中,曲线
(2)下列说法正确的是
A.该反应的反应热为:△H=91kJ?mol-1
B.起始充入的CO为2mol
C.容器中压强恒定时,反应已达平衡状态
D.增加CO浓度,CO的转化率增大
E.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=
(4)以甲醇、空气为主要原料,KOH溶液为电解质溶液,铂为电极构成燃料电池.则该电池中负极上的电极反应式为
(5)已知在常温常压下:
①H2O(g)=H2O(l)△H1=-44.0kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H3=-1275.6kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.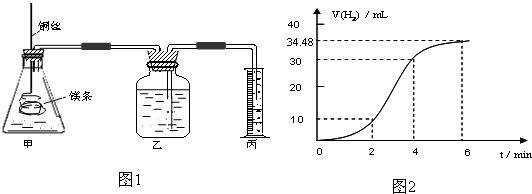
(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是 .(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为 .(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
①上表中V1= mL,V3= mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是 .
③若实验测得t2>t3>t4,则可得出的实验结论是 .
查看习题详情和答案>>

(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是
③若实验测得t2>t3>t4,则可得出的实验结论是
二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
下列说法正确的是
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
(6)燃料电池正极消耗标准状况下空气的体积是
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
3CH4+CO2→2CH3OCH3
3CH4+CO2→2CH3OCH3
.(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
,830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”).(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A、B、C
A、B、C
.(填字母序号)A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
甲醇和水、CO和H2
甲醇和水、CO和H2
.Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.(6)燃料电池正极消耗标准状况下空气的体积是
2.8L
2.8L
(空气中O2体积分数以20%计算).