摘要:19.A.B.C.D.E是原子序数依次增大的五种短周期元素.B.E同主族.且满足最高正化合价+最低负化合价=0,A与C.D与C之间都能形成原子个数比分别为2∶1和1∶1的两种化合物.试解答下列有关问题. (1)在A2C2分子中含有的化学键是 和 . (2)C与D形成的化合物的电子式为 . (3)实验室可用由B.C.D组成的化合物为反应物之一制取由A.C.D组成的化合物.反应的化学方程式为 . (4)写出E单质与A.C.D形成的化合物的水溶液反应的离子方程式 . 解析:据题意知:B为C.E为Si,A为H.C为O.D为Na.形成的化合物分别为H2O和H2O2.Na2O和Na2O2. (1)在H2O2分子中含有极性键和非极性键. (2)Na与O可形成Na2O和Na2O2.电子式分别为: Na+[····]2-Na+.Na+[········]2-Na+ (3)由Na2CO3来制取NaOH.可据反应 Na2CO3+Ca(OH)2===CaCO3↓+2NaOH实现. (4)Si与NaOH反应的离子方程式为: Si+2OH-+H2O===SiO+2H2↑ 答案:(1)极性键 非极性键 (2)Na+[····]2-Na+ Na+[········]2-Na+ (3)Na2CO3+Ca(OH)2===CaCO3↓+2NaOH (4)Si+2OH-+H2O===SiO+2H2↑
网址:http://m.1010jiajiao.com/timu3_id_83308[举报]
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应.试解答下列问题:
(1)B元素的简单离子的结构示意简图为
 .
.
(2)A、D、E元素的名称分别为
(3)E元素在周期表中的位置是第
(4)五种元素的简单离子半径从大到小的顺序是
(5)五种元素中,得电子能力最强的是
查看习题详情和答案>>
(1)B元素的简单离子的结构示意简图为


(2)A、D、E元素的名称分别为
氢
氢
、硫
硫
、铝
铝
.(3)E元素在周期表中的位置是第
三
三
周期ⅥA
ⅥA
族.(4)五种元素的简单离子半径从大到小的顺序是
S2->O2->Na+>Al3+>H+
S2->O2->Na+>Al3+>H+
(用元素离子符号填写).(5)五种元素中,得电子能力最强的是
O
O
,失电子能力最强的是Na
Na
(填元素符号).A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子,请回答下列问题:
(1)D元素的原子结构示意图为
 .
.
(2)由A、B、C三种元素形成的化合物的电子式为
 ,这种化合物形成的晶体中所含的化学键类型有
,这种化合物形成的晶体中所含的化学键类型有
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是
查看习题详情和答案>>
(1)D元素的原子结构示意图为


(2)由A、B、C三种元素形成的化合物的电子式为


离子键、共价键
离子键、共价键
.(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是
ClO-+H2O HClO+OH-
HClO+OH-
 HClO+OH-
HClO+OH-ClO-+H2O HClO+OH-
HClO+OH-
(用离子方程式表示). HClO+OH-
HClO+OH-A、B、C、D、E是原子序数依次增大的五种短周期元素.B、E同主族,且满足最高正化合价+最低负化合价=0;A与C、D与C之间都能形成原子个数比分别为2:1和1:1的两种化合物.试解答下列有关问题.
(1)在A2C2分子中含有的化学键是
(2)C与D形成的化合物的电子式为
 .
.
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式
查看习题详情和答案>>
(1)在A2C2分子中含有的化学键是
极性键
极性键
和非极性键
非极性键
.(2)C与D形成的化合物的电子式为


(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
.(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式
Si+2OH-+H2O═SiO32-+2H2↑
Si+2OH-+H2O═SiO32-+2H2↑
.A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同.A与C、B与D分别分别为同主族,B与C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子,请回答下列问题:
(1)E元素单质的电子式为
 ,D元素简单离子的结构示意图
,D元素简单离子的结构示意图
 .
.
(2)由A、B、C三种元素形成的化合物与E元素单质反应的离子方程式
(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,该反应的化学方程式为
(4)C、D二种元素形成的一种盐,在常温下pH
(5)由A的单质与空气形成的燃料电池中,用KOH溶液作电解质溶液,则负极反应式是
查看习题详情和答案>>
(1)E元素单质的电子式为




(2)由A、B、C三种元素形成的化合物与E元素单质反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,该反应的化学方程式为
H2SO3+H2O2=H2SO4+H2O
H2SO3+H2O2=H2SO4+H2O
.(4)C、D二种元素形成的一种盐,在常温下pH
>
>
7(填“>”“<”或“=”),原因S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
(用离子方程式表示)(5)由A的单质与空气形成的燃料电池中,用KOH溶液作电解质溶液,则负极反应式是
H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
.A、B、C、D、E是原子序数依次增大的五种短周期元素.其中D原子最外层电子数是内层电子总数的3倍;D、E同族;A与D、E既不同族也不同周期;B元素的某种同位素原子在考古方面有重要应用.
(1)E的离子结构示意图为
 .
.
(2)钠、A和D三种元素组成化合物的电子式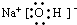
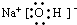 .(或化学键
.(或化学键
(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
(5)处理含BD、ED2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
(6)将0.500mol ED2(g)和0.300mol D2(g)放入容积为10L的密闭容器中,反应:D2(g)+2ED2(g)?2ED3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
②平衡时测得c(D2)=0.10 0mol?Lˉ1,二氧化硫的平衡转化率为
查看习题详情和答案>>
(1)E的离子结构示意图为


(2)钠、A和D三种元素组成化合物的电子式
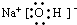
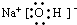
离子键、共价键
离子键、共价键
)(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
H2O2 H++HO2ˉ
H++HO2ˉ
 H++HO2ˉ
H++HO2ˉH2O2 H++HO2ˉ
H++HO2ˉ
. H++HO2ˉ
H++HO2ˉ(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
N2H4+4CuO=N2↑+2Cu2O+2H2O
N2H4+4CuO=N2↑+2Cu2O+2H2O
.(5)处理含BD、ED2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
.(6)将0.500mol ED2(g)和0.300mol D2(g)放入容积为10L的密闭容器中,反应:D2(g)+2ED2(g)?2ED3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
80%
80%
.