题目内容
A、B、C、D、E是原子序数依次增大的五种短周期元素.其中D原子最外层电子数是内层电子总数的3倍;D、E同族;A与D、E既不同族也不同周期;B元素的某种同位素原子在考古方面有重要应用.
(1)E的离子结构示意图为
 .
.
(2)钠、A和D三种元素组成化合物的电子式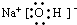
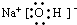 .(或化学键
.(或化学键
(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
(5)处理含BD、ED2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
(6)将0.500mol ED2(g)和0.300mol D2(g)放入容积为10L的密闭容器中,反应:D2(g)+2ED2(g)?2ED3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
②平衡时测得c(D2)=0.10 0mol?Lˉ1,二氧化硫的平衡转化率为
(1)E的离子结构示意图为


(2)钠、A和D三种元素组成化合物的电子式
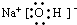
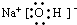
离子键、共价键
离子键、共价键
)(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
H2O2 H++HO2ˉ
H++HO2ˉ
 H++HO2ˉ
H++HO2ˉH2O2 H++HO2ˉ
H++HO2ˉ
. H++HO2ˉ
H++HO2ˉ(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
N2H4+4CuO=N2↑+2Cu2O+2H2O
N2H4+4CuO=N2↑+2Cu2O+2H2O
.(5)处理含BD、ED2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
.(6)将0.500mol ED2(g)和0.300mol D2(g)放入容积为10L的密闭容器中,反应:D2(g)+2ED2(g)?2ED3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
80%
80%
.分析:A、B、C、D、E是原子序数依次增大的五种短周期元素.
D原子最外层电子数是内层电子总数的3倍,则D原子有2个电子层,最外层电子数为6,故D为氧元素;
D、E同族,原子序数E>D,则E为硫元素;A与D、E既不同族也不同周期,则A为氢元素;B元素的某种同位素原子在考古方面有重要应用,则B为碳元素.
D原子最外层电子数是内层电子总数的3倍,则D原子有2个电子层,最外层电子数为6,故D为氧元素;
D、E同族,原子序数E>D,则E为硫元素;A与D、E既不同族也不同周期,则A为氢元素;B元素的某种同位素原子在考古方面有重要应用,则B为碳元素.
解答:解:A、B、C、D、E是原子序数依次增大的五种短周期元素.D原子最外层电子数是内层电子总数的3倍,则D原子有2个电子层,最外层电子数为6,故D为氧元素;D、E同族,原子序数E>D,则E为硫元素;A与D、E既不同族也不同周期,则A为氢元素;B元素的某种同位素原子在考古方面有重要应用,则B为碳元素;C的原子序数具有碳元素与氧元素之间,则C为氮元素.
故A为氢元素;B为碳元素;C为氮元素;D为氧元素;E为硫元素.
(1)E为硫元素,E的离子有3个电子层,核内质子数为16,最外层有8个电子,S2-结构示意图为 .
.
故答案为: .
.
(2)钠、A和D三种元素组成化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为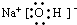 .钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键.
.钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键.
故答案为: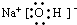 ;离子键、共价键.
;离子键、共价键.
(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,则甲为H2O2,其电离方程式为H2O2 H++HO2ˉ.
H++HO2ˉ.
故答案为:H2O2 H++HO2ˉ.
H++HO2ˉ.
(4)A、C以1:2组成的共价分子乙也含有18电子,则乙为N2H4,N2H4在碱性溶液中能够将CuO还原为Cu2O,每1mol乙参加反应有 4mol电子转移,令氮元素在氧化产物中的化合价为x,根据电子转移守恒,2mol×[x-(-2)]=4mol,解得x=0,则氮元素被氧化为氮气,反应方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O.
(5)处理含CO、SO2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质S.
反应方程式为2CO+SO2=2CO2+S,反应生成1g S固体单质时放出8.4kJ热量,所以生成1molS固体单质放出的热量为
8.4kJ×32=268.8kJ,
此反应的热化学方程式为2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ?molˉ1.
故答案为:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ?molˉ1.
(6)将0.500mol SO2(g)和0.300mol O2(g)放入容积为10L的密闭容器中,反应:O2(g)+2SO2(g)?2SO3(g)在一定条件下达到平衡.
①在一定温度下,可以反应达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,该反应的平衡常数表达式K=
.
②平衡时测得c(O2)=0.100mol?Lˉ1,平衡时氧气的物质的量为10L×0.0100mol?Lˉ1=0.1mol,参加反应的氧气的物质的量为0.3mol-0.1mol=0.2mol,根据反应方程式O2(g)+2SO2(g)?2SO3可知,参加反应的二氧化硫的物质的量为0.4mol,所以二氧化硫的转化率为
×100%=80%.
故答案为:
;80%.
故A为氢元素;B为碳元素;C为氮元素;D为氧元素;E为硫元素.
(1)E为硫元素,E的离子有3个电子层,核内质子数为16,最外层有8个电子,S2-结构示意图为
 .
.故答案为:
 .
.(2)钠、A和D三种元素组成化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为
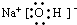 .钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键.
.钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键.故答案为:
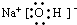 ;离子键、共价键.
;离子键、共价键.(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,则甲为H2O2,其电离方程式为H2O2
 H++HO2ˉ.
H++HO2ˉ.故答案为:H2O2
 H++HO2ˉ.
H++HO2ˉ.(4)A、C以1:2组成的共价分子乙也含有18电子,则乙为N2H4,N2H4在碱性溶液中能够将CuO还原为Cu2O,每1mol乙参加反应有 4mol电子转移,令氮元素在氧化产物中的化合价为x,根据电子转移守恒,2mol×[x-(-2)]=4mol,解得x=0,则氮元素被氧化为氮气,反应方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O.
(5)处理含CO、SO2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质S.
反应方程式为2CO+SO2=2CO2+S,反应生成1g S固体单质时放出8.4kJ热量,所以生成1molS固体单质放出的热量为
8.4kJ×32=268.8kJ,
此反应的热化学方程式为2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ?molˉ1.
故答案为:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ?molˉ1.
(6)将0.500mol SO2(g)和0.300mol O2(g)放入容积为10L的密闭容器中,反应:O2(g)+2SO2(g)?2SO3(g)在一定条件下达到平衡.
①在一定温度下,可以反应达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,该反应的平衡常数表达式K=
| c2(SO3) |
| c(O2)?c2(SO2) |
②平衡时测得c(O2)=0.100mol?Lˉ1,平衡时氧气的物质的量为10L×0.0100mol?Lˉ1=0.1mol,参加反应的氧气的物质的量为0.3mol-0.1mol=0.2mol,根据反应方程式O2(g)+2SO2(g)?2SO3可知,参加反应的二氧化硫的物质的量为0.4mol,所以二氧化硫的转化率为
| 0.4mol |
| 0.5mol |
故答案为:
| c2(SO3) |
| c(O2)?c2(SO2) |
点评:以元素推断为载体,考查结构位置关系、电子式及离子方程式等化学用语、氧化还原反应、热化学方程式、化学平衡常数及平衡计算,难度中等,对所学知识和学生综合能力考查.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
