题目内容
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应.试解答下列问题:
(1)B元素的简单离子的结构示意简图为
 .
.
(2)A、D、E元素的名称分别为
(3)E元素在周期表中的位置是第
(4)五种元素的简单离子半径从大到小的顺序是
(5)五种元素中,得电子能力最强的是
(1)B元素的简单离子的结构示意简图为


(2)A、D、E元素的名称分别为
氢
氢
、硫
硫
、铝
铝
.(3)E元素在周期表中的位置是第
三
三
周期ⅥA
ⅥA
族.(4)五种元素的简单离子半径从大到小的顺序是
S2->O2->Na+>Al3+>H+
S2->O2->Na+>Al3+>H+
(用元素离子符号填写).(5)五种元素中,得电子能力最强的是
O
O
,失电子能力最强的是Na
Na
(填元素符号).分析:A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,则A为氢元素;E的L层电子数是K层和M层电子数之和,则M层电子数=8-2=6,则E为硫元素;B、E同主族,则B为氧元素;C是所有短周期元素中半径最大的元素,则C为Na元素;C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应,则D为Al元素,据此解答.
解答:解:A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,则A为氢元素;E的L层电子数是K层和M层电子数之和,则M层电子数=8-2=6,则E为硫元素;B、E同主族,则B为氧元素;C是所有短周期元素中半径最大的元素,则C为Na元素;C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应,则D为Al元素,
(1)B为氧元素,简单离子为O2-,离子核外有2个电子层,最外层电子数为8,氧离子的结构示意简图为 ,
,
故答案为: ;
;
(2)由上述分析可知,A为氢元素,D为铝元素;E为硫元素,
故答案为:氢;铝;硫;
(3)E为硫元素,氯原子核外有3个电子层,最外层电子数为6,在周期表中的位置是第三周期ⅥA族,
故答案为:三、ⅥA;
(4)电子层越多离子半径越大,电子层结构相同核电荷数越大离子半径越小,故离子半径S2->O2->Na+>Al3+>H+,
故答案为:S2->O2->Na+>Al3+>H+;
(5)非金属性越强得电子能力越强,故得电子能力最强的是O元素,金属性越强失去电子能力越强,故失电子能力最强的是Na元素,
故答案为:O;Na.
(1)B为氧元素,简单离子为O2-,离子核外有2个电子层,最外层电子数为8,氧离子的结构示意简图为
 ,
,故答案为:
 ;
;(2)由上述分析可知,A为氢元素,D为铝元素;E为硫元素,
故答案为:氢;铝;硫;
(3)E为硫元素,氯原子核外有3个电子层,最外层电子数为6,在周期表中的位置是第三周期ⅥA族,
故答案为:三、ⅥA;
(4)电子层越多离子半径越大,电子层结构相同核电荷数越大离子半径越小,故离子半径S2->O2->Na+>Al3+>H+,
故答案为:S2->O2->Na+>Al3+>H+;
(5)非金属性越强得电子能力越强,故得电子能力最强的是O元素,金属性越强失去电子能力越强,故失电子能力最强的是Na元素,
故答案为:O;Na.
点评:本题考查结构性质位置关系、常用化学用语、半径比较、金属性与非金属性强弱比较等,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
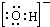
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热