摘要: ⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+).从而实现了高转化率的电解法合成氨.其实验装置如图所示.阴极的电极反应式为 . 答案:⑵ N2 + 6H+ + 6e- = 2NH3
网址:http://m.1010jiajiao.com/timu3_id_82852[举报]
(2011?门头沟区模拟)科学家一直致力于“人工固氮”的方法研究.
(1)目前合成氨的技术原理为:(g)+3H2(g)?2NH3(g);△H=-92.4kJ/molN2
该反应的能量变化如图1所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是:
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1mol,H2为0.3mol,NH3为0.1mol.该条件下H2的转化率为
③欲提高②容器中H2的转化率,下列措施可行的是
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨.其实验装置如图2所示.阴极的电极反应式为
(3)根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
①此合成反应的a
N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol
②已知
O2(g)+2H2(g)2H2O(l);△H=-571.6kJ/mol则2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=kJ/mol
(4)NH4Cl溶液呈酸性,这是由于N
水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是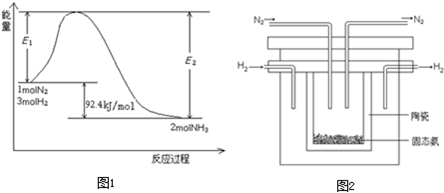
查看习题详情和答案>>
(1)目前合成氨的技术原理为:(g)+3H2(g)?2NH3(g);△H=-92.4kJ/molN2
该反应的能量变化如图1所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是:
减小
减小
.(填“增大”、“减小”或“不变”).②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1mol,H2为0.3mol,NH3为0.1mol.该条件下H2的转化率为
33.3%
33.3%
.③欲提高②容器中H2的转化率,下列措施可行的是
AD
AD
.A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨.其实验装置如图2所示.阴极的电极反应式为
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
大于
大于
0.(填“大于”、“小于”或“等于”)N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol
②已知
O2(g)+2H2(g)2H2O(l);△H=-571.6kJ/mol则2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=kJ/mol
(4)NH4Cl溶液呈酸性,这是由于N
| H | + 4 |
NH4++D2O?NH3?HDO+D+
NH4++D2O?NH3?HDO+D+
.
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4).联氨是一种可燃性液体,可用作火箭燃料.
(1)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;且H2O(l)═H2O(g)△H=+44kJ?mol-1,写出液态联氨与足量过氧化氢反应生成氮气和液态水的热化学方程式: .
(2)如图1所示是一个电化学过程示意图.
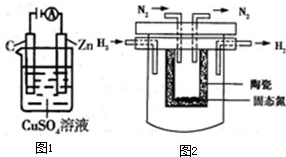
①锌片上发生的电极反应是 .
②假设使用肼-空气燃料电池作为本过程中的电源,锌电极的质量变化是128g,则肼-空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%).
(3)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是 .
(4)1998年希腊亚里士多德大学的Mamellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨,其实验装置如图2所示,该装置中阳极可以产生H+,则阴极的电极反应式为 .
查看习题详情和答案>>
(1)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;且H2O(l)═H2O(g)△H=+44kJ?mol-1,写出液态联氨与足量过氧化氢反应生成氮气和液态水的热化学方程式:
(2)如图1所示是一个电化学过程示意图.

①锌片上发生的电极反应是
②假设使用肼-空气燃料电池作为本过程中的电源,锌电极的质量变化是128g,则肼-空气燃料电池理论上消耗标准状况下的空气
(3)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是
(4)1998年希腊亚里士多德大学的Mamellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨,其实验装置如图2所示,该装置中阳极可以产生H+,则阴极的电极反应式为
 (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:
(2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:(1)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?
该反应为可逆反应,10molN2和30molH2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ
该反应为可逆反应,10molN2和30molH2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ
.(2)如图一在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答:
①N2的转化率αA为
40%
40%
.②在状态A时,平衡常数KA=
| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
>
>
KB(填“>”、“<”或“=”)(3)图二是实验室模拟工业法合成氨的简易装置.简述检验有氨气生成的方法
用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成
用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成
.在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.阴极的电极反应式N2+6e-+6H+=2NH3
N2+6e-+6H+=2NH3
. (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为
t0~t1
t0~t1
;t1时刻改变的反应条件是升温
升温
.②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
bd
bd
(填序号).a.
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
>
>
0,△S>
>
0,(填“>”“<”或“=”).②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=
+l530kJ/mol
+l530kJ/mol
.科学家一直致力于“人工固氨”的新方法研究.目前合成氨技术原理为:
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.
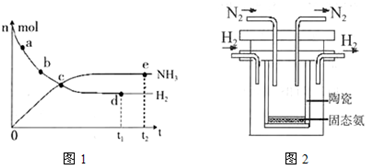
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
(3)K值越大,表明反应达到平衡时
A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.

(1)下列叙述正确的是
AC
AC
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
1.07
1.07
.(3)K值越大,表明反应达到平衡时
C
C
.A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.