题目内容
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4).联氨是一种可燃性液体,可用作火箭燃料.
(1)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;且H2O(l)═H2O(g)△H=+44kJ?mol-1,写出液态联氨与足量过氧化氢反应生成氮气和液态水的热化学方程式: .
(2)如图1所示是一个电化学过程示意图.
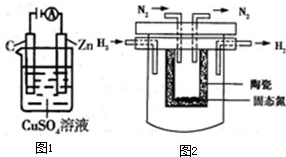
①锌片上发生的电极反应是 .
②假设使用肼-空气燃料电池作为本过程中的电源,锌电极的质量变化是128g,则肼-空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%).
(3)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是 .
(4)1998年希腊亚里士多德大学的Mamellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨,其实验装置如图2所示,该装置中阳极可以产生H+,则阴极的电极反应式为 .
(1)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;且H2O(l)═H2O(g)△H=+44kJ?mol-1,写出液态联氨与足量过氧化氢反应生成氮气和液态水的热化学方程式:
(2)如图1所示是一个电化学过程示意图.

①锌片上发生的电极反应是
②假设使用肼-空气燃料电池作为本过程中的电源,锌电极的质量变化是128g,则肼-空气燃料电池理论上消耗标准状况下的空气
(3)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是
(4)1998年希腊亚里士多德大学的Mamellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨,其实验装置如图2所示,该装置中阳极可以产生H+,则阴极的电极反应式为
分析:(1)先写出液态联氨燃烧的热化学方程式,然后根据盖斯定律来解答;
(2)①电解池的负极上是阳离子发生得电子的还原反应;
②根据电极反应,结合电子守恒和空气的组成情况来回答;
(3)NaClO氧化NH3可以制得肼,还生成氯化钠;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气.
(2)①电解池的负极上是阳离子发生得电子的还原反应;
②根据电极反应,结合电子守恒和空气的组成情况来回答;
(3)NaClO氧化NH3可以制得肼,还生成氯化钠;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气.
解答:解:(1)因12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量,32g液态联氨与足量过氧化氢反应生成氮气和水蒸气放出热量为641.625KJ,所以热化学方程式为:
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.625KJ?mol-1 ①
H2O(l)=H2O(g)△H=+44kJ?mol-1②
依据盖斯定律①-②×4得到:N2H4(l)+2H2O2(l)=N2(g)+4H2O(L)△H=-817.625KJ?mol-1;
(2)①电解池的负极上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,故答案为:112;
(3)NaClO氧化NH3可以制得肼的离子方程式为:ClO-+2NH3=N2H4+Cl-+H2O,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
(4)解答:电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3.
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.625KJ?mol-1 ①
H2O(l)=H2O(g)△H=+44kJ?mol-1②
依据盖斯定律①-②×4得到:N2H4(l)+2H2O2(l)=N2(g)+4H2O(L)△H=-817.625KJ?mol-1;
(2)①电解池的负极上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,故答案为:112;
(3)NaClO氧化NH3可以制得肼的离子方程式为:ClO-+2NH3=N2H4+Cl-+H2O,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
(4)解答:电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3.
点评:本题考查了热化学方程式的书写和盖斯定律的计算应用,电解池原理的应用,电极反应书写方法,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 联氨(N2H4)。
联氨(N2H4)。