摘要:1.限定几种原料.制备一种或几种物质.
网址:http://m.1010jiajiao.com/timu3_id_82402[举报]
W、X、Y、Z四种短周期元素在元素周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物.
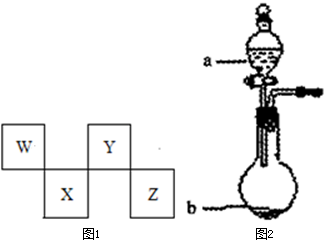
请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号) .
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为 ,Na2Y2中的化学键种类为: .
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是 .
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 .
(5)X的原子结构示意图为 .Z在周期表中的位置 .
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的 极,其电极反应式为 .
查看习题详情和答案>>

请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
(5)X的原子结构示意图为
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).(1)M分子中B原子轨道的杂化类型为
sp2
sp2
,1mol M中含有σ键的数目为3NA(或3×6.02×1023)
3NA(或3×6.02×1023)
.(2)化合物CA3的沸点比化合物BA4的高,其主要原因是
NH3分子间能形成氢键
NH3分子间能形成氢键
.(3)写出与BD2互为等电子体的C3-的结构式
[N=N=N]-
[N=N=N]-
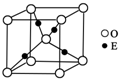
.(4)E+的核外电子排布式为,图是E的某种氧化物的晶胞结构示意图,氧的配位数为
4
4
.(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:
Cu2++4NH3=[Cu(NH3)4]2+
Cu2++4NH3=[Cu(NH3)4]2+
.(2011?昌平区二模)A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素.又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题:
(1)D在元素周期表中的位置是
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
 .
.
(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
(4)写出实验室制备BA3的化学方程式
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
查看习题详情和答案>>
(1)D在元素周期表中的位置是
第三周期第ⅠA族
第三周期第ⅠA族
.(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为


(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;若有1mol电子转移,生成Z的物质的量为0.5
0.5
mol.(4)写出实验室制备BA3的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式
| ||
8NH3+3Br2=N2+6NH4++6Br-
8NH3+3Br2=N2+6NH4++6Br-
.(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
N2H4+4OH--4e-═N2+4H2O
N2H4+4OH--4e-═N2+4H2O
.以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)13
13
.(2011?南京一模)镍配合物在传感器、磁记录材料、储氢材料等方面有着广泛的应用 以镍片为原料制备一种镍配合物[Ni(NH3)xCl2的主要流程如下:

(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是
(2)氨化过程中控制溶液pH=9,可防止产品中混有“Ni(0H)3 沉淀,此时溶液中c(Ni2+)≤
(3)准确称取0.232g[Ni(NH3)x]Cl2样品.溶于水后加入2.00ml.6mol.L-1 HCl,用0.25mol.L-1NaOH溶液滴定过量的盐酸,消耗NaOH溶液24.00mL 通过计算来确定x的值
(4)若在[Ni(NH3)x]Cl2?样品中存在Ni(OH)2杂质,则上述实验测定的x值
查看习题详情和答案>>

(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是
反应快,易蒸干
反应快,易蒸干
.若选用稀硝酸,其优点是溶解单位质量的镍所耗稀HNO3质量少
溶解单位质量的镍所耗稀HNO3质量少
.(2)氨化过程中控制溶液pH=9,可防止产品中混有“Ni(0H)3 沉淀,此时溶液中c(Ni2+)≤
5.0×10-6mol?L-1
5.0×10-6mol?L-1
.(已知Ksp[Ni(OH)2]=5.0×10-16)(3)准确称取0.232g[Ni(NH3)x]Cl2样品.溶于水后加入2.00ml.6mol.L-1 HCl,用0.25mol.L-1NaOH溶液滴定过量的盐酸,消耗NaOH溶液24.00mL 通过计算来确定x的值
6
6
.已知:[Ni(NH3)x]Cl2+HCl→NiCl2+NH4Cl(来配平、写出解题过程)(4)若在[Ni(NH3)x]Cl2?样品中存在Ni(OH)2杂质,则上述实验测定的x值
偏小
偏小
(填“偏大”、“偏小”或“不变”).(2013?闸北区二模)工业上通常以铝土矿(主要成分为Al2O3)为原料制备无水氯化铝:2Al2O3+6Cl2
4AlCl3+3O2↑.请回答下列问题:
(1)上述反应涉及的元素中,最外层有2个未成对电子的元素是
(2)已知元素周期表中,镓(31Ga)与铝元素同一主族,写出Ga的最外层电子排布式:
(3)镓(Ga)有两种天然同位素,一种是
Ga,其原子在天然同位素原子中所占的百分比为60%.实验测得溴化镓(GaBr3)的摩尔质量为309.8g/mol,则由此推知镓的另一种同位素是
(4)为促进反应的进行,实际生产中需加入焦炭,其原因是
查看习题详情和答案>>
| △ |
(1)上述反应涉及的元素中,最外层有2个未成对电子的元素是
O
O
;简单离子的离子半径最小的元素,其原子核外有5
5
种不同能级的电子.(2)已知元素周期表中,镓(31Ga)与铝元素同一主族,写出Ga的最外层电子排布式:
4s24p1
4s24p1
(3)镓(Ga)有两种天然同位素,一种是
69 31 |
3171Ga
3171Ga
.(4)为促进反应的进行,实际生产中需加入焦炭,其原因是
碳与O2反应,有利于反应正向进行
碳与O2反应,有利于反应正向进行
.