题目内容
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).(1)M分子中B原子轨道的杂化类型为
sp2
sp2
,1mol M中含有σ键的数目为3NA(或3×6.02×1023)
3NA(或3×6.02×1023)
.(2)化合物CA3的沸点比化合物BA4的高,其主要原因是
NH3分子间能形成氢键
NH3分子间能形成氢键
.(3)写出与BD2互为等电子体的C3-的结构式
[N=N=N]-
[N=N=N]-
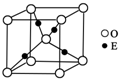
.(4)E+的核外电子排布式为,图是E的某种氧化物的晶胞结构示意图,氧的配位数为
4
4
.(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:
Cu2++4NH3=[Cu(NH3)4]2+
Cu2++4NH3=[Cu(NH3)4]2+
.分析:A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B是C元素;D原子有2个未成对电子,且D原子半径小于B,且D是O元素,C的原子半径小于B而大于D,则C是N元素,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则该气体是甲醛,所以A是H元素,E的硫酸盐溶液是制备波尔多液的原料之一,则E是铜元素,根据物质的结构和性质解答.
解答:解:A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B是C元素;D原子有2个未成对电子,且D原子半径小于B,且D是O元素,C的原子半径小于B而大于D,则C是N元素,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则该气体是甲醛,所以A是H元素,E的硫酸盐溶液是制备波尔多液的原料之一,则E是铜元素,
(1)M是HCHO,甲醛分子中C原子含有3个价层电子对,所以其原子轨道的杂化类型为sp2,一个甲醛分子中含有3个σ键,所以 1mol M中含有σ键的数目为 3NA(或3×6.02×1023),
故答案为:sp2,3NA(或3×6.02×1023);
(2)化合物NH3的沸点比化合物CH4的高,氨气中存在氢键,甲烷中不含氢键,氢键的存在导致其沸点增大,故答案为:NH3分子间能形成氢键;
(3)等电子体的结构相似,所以与CO2互为等电子体的N3-的结构式[N=N=N]-,
故答案为:[N=N=N]-;
(4)Cu+的核外有28个电子,根据构造原理知,其基态核外电子排布式为1s22s22p63s23p63d10,图是Cu的某种氧化物的晶胞结构示意图,根据晶胞图知氧的配位数为4,
故答案为:1s22s22p63s23p63d10,4;
(5)硫酸铜和氨气反应生成铜氨络合物,离子反应方程式为:Cu2++4NH3=[Cu(NH3)4]2+,
故答案为:Cu2++4NH3=[Cu(NH3)4]2+.
(1)M是HCHO,甲醛分子中C原子含有3个价层电子对,所以其原子轨道的杂化类型为sp2,一个甲醛分子中含有3个σ键,所以 1mol M中含有σ键的数目为 3NA(或3×6.02×1023),
故答案为:sp2,3NA(或3×6.02×1023);
(2)化合物NH3的沸点比化合物CH4的高,氨气中存在氢键,甲烷中不含氢键,氢键的存在导致其沸点增大,故答案为:NH3分子间能形成氢键;
(3)等电子体的结构相似,所以与CO2互为等电子体的N3-的结构式[N=N=N]-,
故答案为:[N=N=N]-;
(4)Cu+的核外有28个电子,根据构造原理知,其基态核外电子排布式为1s22s22p63s23p63d10,图是Cu的某种氧化物的晶胞结构示意图,根据晶胞图知氧的配位数为4,
故答案为:1s22s22p63s23p63d10,4;
(5)硫酸铜和氨气反应生成铜氨络合物,离子反应方程式为:Cu2++4NH3=[Cu(NH3)4]2+,
故答案为:Cu2++4NH3=[Cu(NH3)4]2+.
点评:本题考查物质结构和性质,正确推断元素是解本题关键,难点是等电子体电子式或结构式的书写,难度中等.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 如图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:A
如图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:A (2011?丹东模拟) 化学一一选修物质结构与性质
(2011?丹东模拟) 化学一一选修物质结构与性质