网址:http://m.1010jiajiao.com/timu3_id_82365[举报]
 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:①4FeO?Cr2O3+8Na2CO3+7O2
| ||
. |
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是
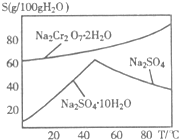
(2)右图是红矾钠(Na2Cr2O7?2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是
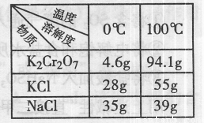
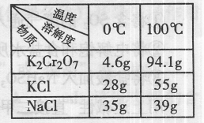
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol?L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式
②如省去步骤③,则所测定的铁的含量
③步骤5使用的玻璃仪器有
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
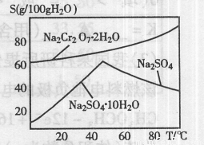
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
查看习题详情和答案>>
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
查看习题详情和答案>>
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶 解
解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
①4FeO·Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是
 。
。(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
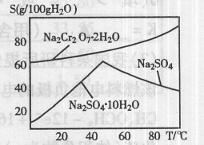
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶
 解
解步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有