网址:http://m.1010jiajiao.com/timu3_id_82316[举报]
(1)从下列仪器中选出所需仪器(用标号字母填写)____________________;
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是_____________________________。
(2)本次实验中至少要在天平上进行四次称量。第一次做_____________的称量;第二次做__________________的称量;第三次做___________________的称量;第四次做___________的称量。第一、二次称量的目的是___________________________,第三、四次称量的目的是_____________________________。
(3)某学生实验后得到以下数据:
加热前质量 | 加热后质量 | |
W1(容器) | W3(容器+晶体) | W3(容器+无水硫酸铜) |
5.4 g | 7.9 g | 6.8 g |
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示):
x%=______________________。
该生测定结果是偏高还是偏低?____________。
从下列分析中选出该学生产生实验误差的原因可能是__________(填写字母)。
A.加热前称量时容器未完全干燥
B.最后两次加热后质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量固体溅失
(4)问题与讨论:
①加热硫酸铜晶体时应注意什么?____________________________________________。
②要求测定结果准确,你觉得有重复称量的必要吗?________________________________。
 某课外活动小组做了如下关于钾的探究实验.
某课外活动小组做了如下关于钾的探究实验.(1)钾与水反应
实验中钾常会着火燃烧,并发生轻微爆炸,由此现象可以得出的结论是
(2)钾与氯气反应
该实验中可选用如下方案制备氯气,其中最合理的是
| 方案序号 | 所用试剂 | 净化剂 | 干燥剂 |
| A | MnO2、稀盐酸 | 饱和食盐水 | 浓硫酸 |
| B | Ca(ClO)2、浓盐酸 | 饱和食盐水 | 无水硫酸铜 |
| C | 氯酸钾、浓盐酸 | 饱和碳酸钠溶液 | 浓硫酸 |
| D | KMnO4、浓盐酸 | 水 | 碱石灰 |
A.长颈漏斗 B.圆底烧瓶
C.酒精灯 D.洗气瓶
(3)钾与氧气反应的实验
经查找资料知:钾与氧气反应可能生成K2O、K2O2、KO2.
①取一定量的钾在空气中点燃,使其充分反应;
②将生成物研成细粉备用;
③常温下,利用如图所示装置探究生成物成分及含量.
据此回答下列问题:
①使细粉末与水反应的操作是
②测量气体体积时应注意的事项是
③若钾与氧气燃烧的产物为K2O2、KO2,取燃烧产物3.94g进行上述实验,测得气体的体积为868.0mL,则KO2的质量分数约为
(已知:常温下,气体的摩尔体积为24.8L/mol)
某化学课外活动小组在实验室做了如下一系列实验: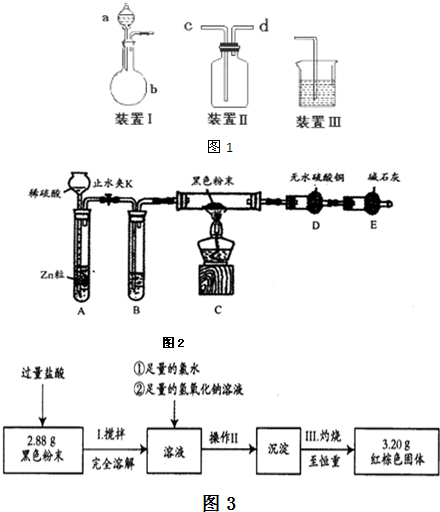
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
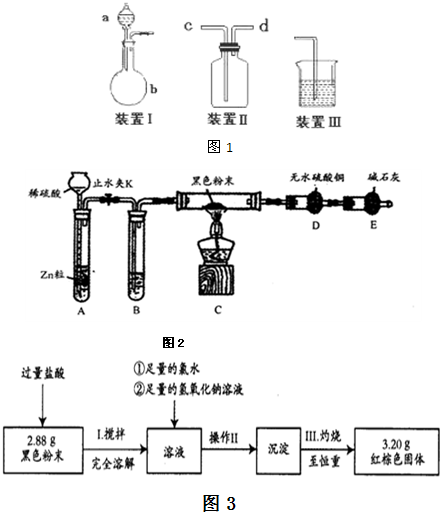
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
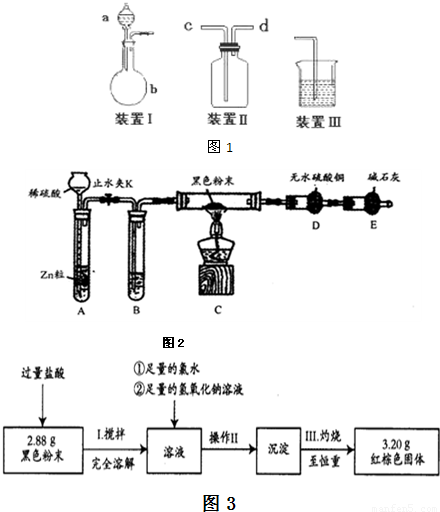
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>