摘要:1.一石激起千层浪.叛逃英国的俄罗斯前特工利特维年科2006年11月23日晚在世界的关注中“缓慢而公开地死去 .直到死前3个小时才查出真正的病因--放射性元素钋-PO中毒.钋-210属于极毒性放射性元素.以相同重量来比较.钋-210的毒性是氰化物的2.5亿倍.只需一颗尘埃大小就足以取人性命.而且没有解毒剂.下列有关PO说法正确的是 ( ) A.PO 与PO 互为同素异形体 B.PO 与At互为同位素 C.PO 是一种质子数为84.中子数为126的钋原子 D. PO元素的相对原子量为210
网址:http://m.1010jiajiao.com/timu3_id_82036[举报]
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)Y分别与D、E形成的化合物中熔点较高是___________(用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是____________(用元素符号表示)。
(2)LX2分子的电子式是__________;XY2分子是_________(填“极性分子”或“非极性分子”);
QY3分子的立体结构是_____________。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)5,其中J的化合价是0价。则J原子的基态核外电子排布式是____________;与配体粒子互为等电子体的离子是_________;J(LR)5固态时属于______ 晶体(填晶体类型)。
(4)L的一种单质是层状结构,英国曼彻斯特大学的海娒和诺沃肖洛夫通过撕胶带的方法获得了单层的二维结构材料,并发现这种材料具有独特的电子传导速度和强度,二人获得了2010年诺贝尔物理学奖。该材料结构如甲图,其中L原子是_________杂化,若在其中镶嵌E原子,其结构如乙图,该物质的化学式为
___________。
(2)LX2分子的电子式是__________;XY2分子是_________(填“极性分子”或“非极性分子”);
QY3分子的立体结构是_____________。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)5,其中J的化合价是0价。则J原子的基态核外电子排布式是____________;与配体粒子互为等电子体的离子是_________;J(LR)5固态时属于______ 晶体(填晶体类型)。
(4)L的一种单质是层状结构,英国曼彻斯特大学的海娒和诺沃肖洛夫通过撕胶带的方法获得了单层的二维结构材料,并发现这种材料具有独特的电子传导速度和强度,二人获得了2010年诺贝尔物理学奖。该材料结构如甲图,其中L原子是_________杂化,若在其中镶嵌E原子,其结构如乙图,该物质的化学式为
___________。

 (2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
B
B
BC
C
CO
O
DCl
Cl
,EBr
Br
;(2)A与D形成的化合物的化学式为
BCl3
BCl3
,其分子的立体构型是平面正三角形
平面正三角形
,是非极性
非极性
(填“极性”或“非极性”)分子;(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:
I2
I2
>Br2
Br2
>BrCl
BrCl
>Cl2
Cl2
,其理由是
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
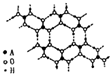
.(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是
sp2
sp2
;②在晶体中,H3AO3分子能形成这种排列方式的原因是
H3BO3分子之间氢原子与氧原子之间存在氢键
H3BO3分子之间氢原子与氧原子之间存在氢键
;③在H3AO3晶体中层与层之间的作用力是
分子间作用力
分子间作用力
,该晶体属于分子
分子
晶体.A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:
(2)写出E元素的元素符号: ,其价电子排布图为:
(3)A与D形成化合物的化学式为 ,是 分子(填“极性”或“非极性”)
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是 ,该晶体属于 晶体.
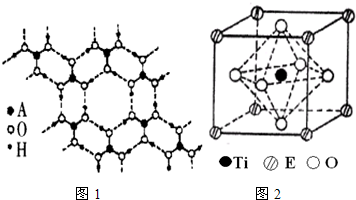
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为 个、 个.
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为 ,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是 ,E的配位数是 .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为

(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为
元素A、B的原子序数都小于18,已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a一b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有 ( )
A.能与水反应 B.能与盐酸反应 C.能与NaOH溶液反应 D.能与硫酸钠反应
查看习题详情和答案>>
A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(1)写出下列元素的符号:A______B______C______D______,E______;
(2)A与D形成的化合物的化学式为______,其分子的立体构型是______,是______(填“极性”或“非极性”)分子;
(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:______>______>______>______,
其理由是______.
(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是______;
②在晶体中,H3AO3分子能形成这种排列方式的原因是______;
③在H3AO3晶体中层与层之间的作用力是______,该晶体属于______晶体.
 查看习题详情和答案>>
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
(2)A与D形成的化合物的化学式为______,其分子的立体构型是______,是______(填“极性”或“非极性”)分子;
(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:______>______>______>______,
其理由是______.
(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是______;
②在晶体中,H3AO3分子能形成这种排列方式的原因是______;
③在H3AO3晶体中层与层之间的作用力是______,该晶体属于______晶体.
 查看习题详情和答案>>
查看习题详情和答案>>