摘要:请写出下列物质在溶液中水解的离子方程式:1.H2SO4
网址:http://m.1010jiajiao.com/timu3_id_81781[举报]
下图表示有关物质(均是中学化学常见的物质)之间的转化关系(部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体、F为红褐色沉淀.回答下列问题:

(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应.则甲为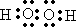
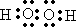 ,A与B物质的量应满足的关系为
,A与B物质的量应满足的关系为
(2)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生.请写出反应②发生的化学反应方程式
(3)写出反应③的离子反应方程式
(4)写出Z中阳离子的检验方法
查看习题详情和答案>>

(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应.则甲为
H2SO4
H2SO4
,C为Fe
Fe
(填写化学式).乙物质的电子式为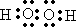
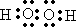
n(A):n(B)>1:1
n(A):n(B)>1:1
.(2)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生.请写出反应②发生的化学反应方程式
Cu+H2SO4+H2O2=CuSO4+2H2O
Cu+H2SO4+H2O2=CuSO4+2H2O
,产生气体的原因是2H2O2=2H2O+O2↑,Fe3+催化双氧水分解
2H2O2=2H2O+O2↑,Fe3+催化双氧水分解
.(3)写出反应③的离子反应方程式
4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑
4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑
.(4)写出Z中阳离子的检验方法
滴加KSCN溶液,若溶液呈血红色则为Fe3+
滴加KSCN溶液,若溶液呈血红色则为Fe3+
.《化学与生活》
(1)现有下列物质:脂肪、甘油、多糖、蛋白质、维生素A、维生素C、碘元素、铁元素.请选择正确答案填在相应的空格里.
①人体缺乏某种维生素会引起坏血病,这种维生素是
②人体缺乏某种微量元素会发生贫血,这种微量元素是
③既能为人体提供热量,又能提供必需脂肪酸的物质是
④纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
(2)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝.
①其中属于解热镇痛的药物是
②青霉素的作用是
③碳酸镁可治疗胃酸过多的原理是
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是
(3)人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸.这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量.
①蛋白质分子中主要含有
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性.这个过程称为
④人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为
查看习题详情和答案>>
(1)现有下列物质:脂肪、甘油、多糖、蛋白质、维生素A、维生素C、碘元素、铁元素.请选择正确答案填在相应的空格里.
①人体缺乏某种维生素会引起坏血病,这种维生素是
维生素C
维生素C
.②人体缺乏某种微量元素会发生贫血,这种微量元素是
铁元素
铁元素
.③既能为人体提供热量,又能提供必需脂肪酸的物质是
脂肪
脂肪
.④纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
多糖
多糖
.(2)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝.
①其中属于解热镇痛的药物是
阿司匹林
阿司匹林
.②青霉素的作用是
消炎
消炎
.③碳酸镁可治疗胃酸过多的原理是
MgCO3+H+═Mg2++H2O+CO2↑
MgCO3+H+═Mg2++H2O+CO2↑
(用离子方程表示).④药片常用淀粉作为黏合剂,淀粉水解的最终产物是
葡萄糖
葡萄糖
.(3)人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸.这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量.
①蛋白质分子中主要含有
C、H、O、N
C、H、O、N
四种元素.②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和
羧基或-COOH
羧基或-COOH
(写结构简式或名称).③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性.这个过程称为
盐析
盐析
.④人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为
必需
必需
氨基酸.
《化学与生活》
(1)现有下列物质:脂肪、甘油、多糖、蛋白质、维生素A、维生素C、碘元素、铁元素.请选择正确答案填在相应的空格里.
①人体缺乏某种维生素会引起坏血病,这种维生素是______.
②人体缺乏某种微量元素会发生贫血,这种微量元素是______.
③既能为人体提供热量,又能提供必需脂肪酸的物质是______.
④纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种______.
(2)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝.
①其中属于解热镇痛的药物是______.
②青霉素的作用是______.
③碳酸镁可治疗胃酸过多的原理是______(用离子方程表示).
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是______.
(3)人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸.这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量.
①蛋白质分子中主要含有______四种元素.
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和______(写结构简式或名称).
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性.这个过程称为______.
④人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为______氨基酸.
查看习题详情和答案>>
(1)现有下列物质:脂肪、甘油、多糖、蛋白质、维生素A、维生素C、碘元素、铁元素.请选择正确答案填在相应的空格里.
①人体缺乏某种维生素会引起坏血病,这种维生素是______.
②人体缺乏某种微量元素会发生贫血,这种微量元素是______.
③既能为人体提供热量,又能提供必需脂肪酸的物质是______.
④纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种______.
(2)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝.
①其中属于解热镇痛的药物是______.
②青霉素的作用是______.
③碳酸镁可治疗胃酸过多的原理是______(用离子方程表示).
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是______.
(3)人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸.这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量.
①蛋白质分子中主要含有______四种元素.
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和______(写结构简式或名称).
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性.这个过程称为______.
④人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为______氨基酸.
查看习题详情和答案>>
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.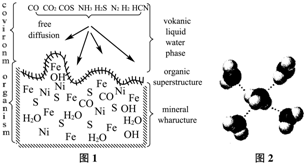
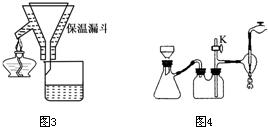
A.海底热液研究(图1)处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Ni2+的核外电子排布式是
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化 D.CO、H2S、HCN都是极性分子
(4)“酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是
B.制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离.下面是某化学兴趣小组的活动记录:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
实验方案:
Ⅰ.溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
Ⅱ.蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图3所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ.冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤.得KNO3粗产品m2g.
Ⅳ.重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤.得KNO3纯品.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:
(1)操作Ⅱ中趁热过滤的目的是.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=
(3)操作Ⅲ中采用减压过滤,其优点是
运用所学的化学反应原理研究化学反应很有意义.请回答下列问题:
(1)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
已知1mol H2O(g)转变为1molH2O(l)时放热44.0kJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式
(2)500°C、50Mpa时,在容积为VL的定容容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为
.
(3)若把标准状况下4.48L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
(4)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.有沉淀析出的是
(5)以磷酸亚铁锂(LiFePO4)为电极材料的新型锂离子电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
查看习题详情和答案>>
(1)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol
.(2)500°C、50Mpa时,在容积为VL的定容容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |
(3)若把标准状况下4.48L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
NH4HSO4
NH4HSO4
,溶液中离子浓度从大到小的顺序是c(H+)>c(SO42-)>c(NH+4)>c(OH-)
c(H+)>c(SO42-)>c(NH+4)>c(OH-)
.(4)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.有沉淀析出的是
b
b
点(填字母).a点对应的Ksp 
等于
等于
c点对应的Ksp (填大于、等于或小于)(5)以磷酸亚铁锂(LiFePO4)为电极材料的新型锂离子电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
FePO4+Li++e-═LiFePO4
FePO4+Li++e-═LiFePO4
.