网址:http://m.1010jiajiao.com/timu3_id_81458[举报]
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究.
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol?L-1)加到装置甲中,塞上橡皮塞.
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关.
iii.测定干燥管I增加的质量.
(1)写出装置乙中反应的离子方程式:
(2)装置丙中的试剂是
(3)假定上述实验中的气体都被充分吸收.若干燥管I增重1.408g.则CN-被处理的百分率为
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将
Ⅱ.防治空气污染,燃煤脱硫很重要.目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果.
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2.
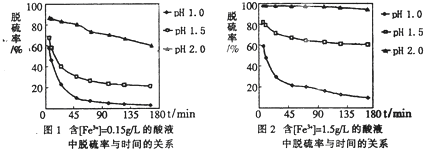
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去.
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀.
上述实验方案中不合理的是
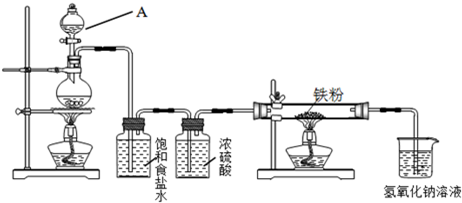
(1)A仪器的名称是
(2)上述制备氯气的化学反应方程式为
(3)浓硫酸的作用是
(4)为探究铁与氯气反应的产物,某小组同学提出如下设想:
①产物只有FeCl3;②产物只有FeCl2;③
甲同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果未出现血红色,再滴加氯水,出现血红色,得出结论为②是正确的;
乙同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果出现血红色,则产物中必含FeCl3.
请问上述观点错误的是
保护环境是全球关注的问题。
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。
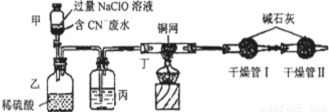
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol·L-1)加到装置甲中,塞上橡皮塞。
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关。
iii.测定干燥管I增加的质量。
(1)写出装置乙中反应的离子方程式: 。
(2)装置丙中的试剂是 ,装置丁的作用是 。
(3)假定上述实验中的气体都被充分吸收。若干燥管I增重1.408g。则CN-被处理的百分率为 。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将 (填“偏高”、“偏低”、“无法确定”或“无影响”)。简述你的理由: 。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2。
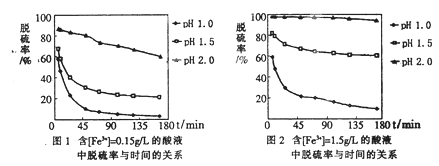
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是 、 。
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去。
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是 。
查看习题详情和答案>>
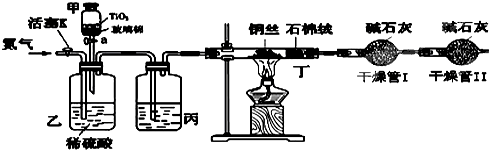
(11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
(11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
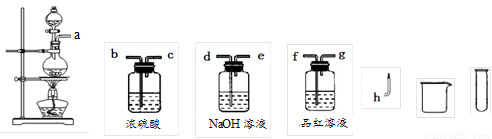
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
查看习题详情和答案>>