题目内容
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气探究其性质,据此回答下列问题: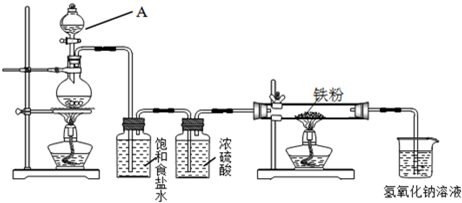
(1)A仪器的名称是
(2)上述制备氯气的化学反应方程式为
(3)浓硫酸的作用是
(4)为探究铁与氯气反应的产物,某小组同学提出如下设想:
①产物只有FeCl3;②产物只有FeCl2;③
甲同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果未出现血红色,再滴加氯水,出现血红色,得出结论为②是正确的;
乙同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果出现血红色,则产物中必含FeCl3.
请问上述观点错误的是
分析:(1)A仪器名称是分液漏斗,所盛放试剂是液体浓盐酸;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,依据氯化氢在氧化还原反应中的作用和盐酸化合价变化计算被还原和未被还原的物质的量之比;
(3)氯气制备过程中混入了氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,浓硫酸除去水蒸气,最后烧杯中的氢氧化钠溶液是吸收过量的氯气避免排放到空气中污染环境;
(4)依据设想①②分析组合可知,设想③应为既有FeCl3 又有FeCl2,甲同学的实验设计过程中固体样品溶于水滴加KSCN溶液,如果未出现血红色,可能是原反应得到固体是铁和氯化铁固体,溶于水氯化铁和铁全部反应生成亚铁离子,再滴加氯水,出现血红色.
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,依据氯化氢在氧化还原反应中的作用和盐酸化合价变化计算被还原和未被还原的物质的量之比;
(3)氯气制备过程中混入了氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,浓硫酸除去水蒸气,最后烧杯中的氢氧化钠溶液是吸收过量的氯气避免排放到空气中污染环境;
(4)依据设想①②分析组合可知,设想③应为既有FeCl3 又有FeCl2,甲同学的实验设计过程中固体样品溶于水滴加KSCN溶液,如果未出现血红色,可能是原反应得到固体是铁和氯化铁固体,溶于水氯化铁和铁全部反应生成亚铁离子,再滴加氯水,出现血红色.
解答:解:(1)装置中添加浓盐酸通过分液漏斗,所以A仪器名称是分液漏斗,故答案为:分液漏斗.
(2)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,反应中氯化氢每4mol反应有2mol被二氧化锰氧化生成氯气,2molHCl反应 生成氯化锰,显示的是酸性,未被氧化,反应中浓盐酸被氧化和未被氧化的物质的量之比为1:1;
故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O;1:1;
(3)氯气制备过程中混入了氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,浓硫酸除去水蒸气,干燥氯气的作用,最后烧杯中的氢氧化钠溶液是吸收过量的氯气避免排放到空气中污染环境,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:干燥氯气;Cl2+2OH-═Cl-+ClO-+H2O;吸收多余的氯气;
(4)依据设想①②分析组合可知,设想③固体组成可能为:既有FeCl3 又有FeCl2,甲同学的实验设计过程中固体样品溶于水滴加KSCN溶液,如果未出现血红色,可能是原反应得到固体是过量铁和氯化铁固体,溶于水氯化铁和铁全部反应生成亚铁离子,Fe+2Fe3+═3Fe2+,再滴加氯水,出现血红色;乙同学设计的实验方案是检验铁离子的反应现象,设计合理,
故答案为:既有FeCl3 又有FeCl2;甲;若铁有余,则发生Fe+2Fe3+═3Fe2+,滴加KSCN溶液,也不会血红色.
(2)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)
| ||
故答案为:4HCl(浓)+MnO2
| ||
(3)氯气制备过程中混入了氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,浓硫酸除去水蒸气,干燥氯气的作用,最后烧杯中的氢氧化钠溶液是吸收过量的氯气避免排放到空气中污染环境,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:干燥氯气;Cl2+2OH-═Cl-+ClO-+H2O;吸收多余的氯气;
(4)依据设想①②分析组合可知,设想③固体组成可能为:既有FeCl3 又有FeCl2,甲同学的实验设计过程中固体样品溶于水滴加KSCN溶液,如果未出现血红色,可能是原反应得到固体是过量铁和氯化铁固体,溶于水氯化铁和铁全部反应生成亚铁离子,Fe+2Fe3+═3Fe2+,再滴加氯水,出现血红色;乙同学设计的实验方案是检验铁离子的反应现象,设计合理,
故答案为:既有FeCl3 又有FeCl2;甲;若铁有余,则发生Fe+2Fe3+═3Fe2+,滴加KSCN溶液,也不会血红色.
点评:本题考查了实验室制备氯气的装置分析,气体除杂和试剂选择,物质组成的实验验证方案设计师解题关键,主要是铁离子、亚铁离子的检验方法,题目难度中等.

练习册系列答案
相关题目
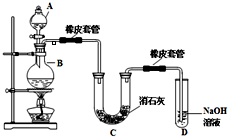 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
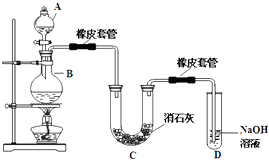 瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: