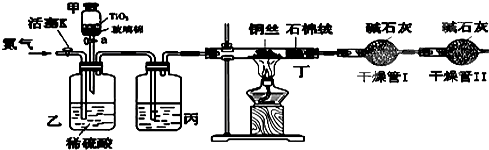
题目内容
保护环境是全球关注的问题。
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。
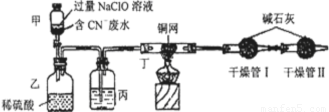
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol·L-1)加到装置甲中,塞上橡皮塞。
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关。
iii.测定干燥管I增加的质量。
(1)写出装置乙中反应的离子方程式: 。
(2)装置丙中的试剂是 ,装置丁的作用是 。
(3)假定上述实验中的气体都被充分吸收。若干燥管I增重1.408g。则CN-被处理的百分率为 。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将 (填“偏高”、“偏低”、“无法确定”或“无影响”)。简述你的理由: 。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
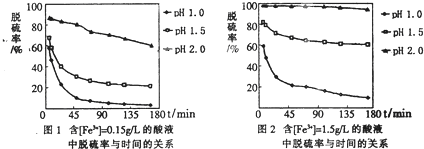
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2。
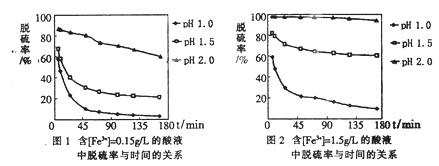
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是 、 。
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去。
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是 。
(16分)(1)2CNO—+6ClO—+8H+=N2↑+2CO2↑+3Cl2↑+4H2O(3分)
(2)浓硫酸(2分) 吸收混合气中的Cl2(2分)
(3)80.0%(2分)
(4)注:本小题为开放题,评分说明如下:
偏高的理由:部分Cl2在装置丁没有被吸收而在干燥管I中被吸收;偏低的理由:部分Cl2残留在装置内没有在干燥管I中被吸收;无法确定的理由:部分Cl2在干燥管I中被吸收,部分CO2没有在干燥管I中被吸收;理由正确给3分,理由错误不给分;
(5)1.50g/L 2.0(各1分,共2分)
(6)方案①(2分)
【解析】
试题分析:(1)由电子、电荷、原子守恒可知,乙中反应式为2CNO—+6ClO—+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;(2)丙的目的是除去水分,其中所盛液体为浓硫酸;丁的目的是吸收混合气中的氯气,防止污染环境;(3)I吸收1.408gCO2,由m/M可知,n(CO2)=1.408g÷44g/mol=0.032mol,由2CNO—+6ClO—+8H+=N2↑+2CO2↑+3Cl2↑+4H2O可知,n(CNO—)=n(CO2)=0.032mol,则被处理的n(CN—)=n(CNO—)=0.032mol,由cV可知,总的n(CN—)=0.200mol·L-1×0.2L=0.04mol,则CN—被处理的百分率为0.032mol÷0.04mol×100%=80.0%;(4)本小题为开放题,①偏高的理由:部分Cl2在装置丁没有被吸收而在干燥管I中被吸收;②偏低的理由:部分Cl2残留在装置内没有在干燥管I中被吸收;③无法确定的理由:部分Cl2在干燥管I中被吸收,部分CO2没有在干燥管I中被吸收;(5)读图可知,其他条件相同时,Fe3+浓度越大,脱硫率越高;pH越小,脱硫率越低;故Fe3+浓度为1.50g/L、pH=2.0时,脱硫率最佳;(6)过量的SO2和反应产生的Fe2+都具有还原性,都能使酸性高锰酸钾溶液褪色,方案①不合理。
考点:考查综合实验、化学计算、化学实验方案的设计与评价等相关知识。