摘要:如图是部分短周期元素的单质及其化合物间的转化关系图(有关反应的条件及生成的H2O已略去).已知:(a)A.B.C为单质.且在常温常压下为气体,(b)反应①.③为化工生产中的重要反应.而②为雷雨闪电时发生的反应,(c)化合物D具有漂白性.可由Cl2与NaOH化合物H由两种元素组成.其相对分子质量为32. 请回答下列问题: (1)反应①的条件是 . 其中符合平衡移动原理的反应条件是 . (2)上述物质中. 是造成光化学烟雾的主要因素. (3)反应③中.每有0.2 mol E完全反应.则转移电子 mol. (4)E与H的性质相似.你预测H的水溶液的pH 7(填“> .“= 或“< ).原因是 .在固态时.H为 晶体.其沸点比E . (5)反应⑤的化学方程式为 . 解析:由反应②发生的条件知F为NO.I是NO2.J是HNO3.C是O2.B是N2.再根据其他转化关系及物质状态知A是H2.E是NH3.反应③中1 mol NH3转化为NO时失去5 mol e-.0.2 mol NH3完全反应时失去1 mol e-. (4)由NH3的性质与H相似知H的水溶液的pH>7.对比NH3+ H2ONH4++OH-可得N2H4+2H2ON2H62++2OH-.H是分子晶体. 答案:(1)高温.高压.催化剂 高压 > N2H4+2H2ON2H62++2OH- 分子 高 (5)N2H4+O2N2+2H2O
网址:http://m.1010jiajiao.com/timu3_id_81445[举报]
 如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:(1)③号元素的原子结构示意图
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为
(3)⑦号元素的原子核外电子排布式为
(4)②,④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚相似,该结构的晶体属
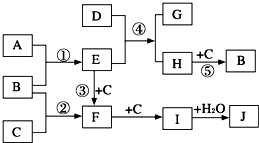 (2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
(2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).已知:(a)A、B、C为单质,且在常温常压下为气体;
(b)反应①③为化工生产中的重要反应,而②为雷雨闪电时发生的反应;
(c)化合物D具有漂白性,可由C12与NaOH(aq)反应而制得;
(d)化合物H由两种元素组成,其相对分子质量为32.
请回答下列问题:?
(1)反应①的条件是
高温、高压、催化剂
高温、高压、催化剂
,其中符合平衡移动原理的反应条件是高压、高温
高压、高温
?(2)上述物质中,
I
I
(填字母序号)是造成光化学烟雾的主要因素.?(3)反应③中,每有0.2molE完全反应,则电子转移为
1
1
mol.?(4)E与H的结构、性质相似,你预测H的水溶液的pH7(填:“>”、“=”或“<”),原因是
N2H4+2H2O?N2H62++2OH-
N2H4+2H2O?N2H62++2OH-
.用离子方程式表示).在固态时,H为分子
分子
晶体,其沸点比E高
高
(填“高”或“低”). (5)反应⑤的化学方程式为
N2H4+O2
N2+2H2O
| ||
N2H4+O2
N2+2H2O
.
| ||
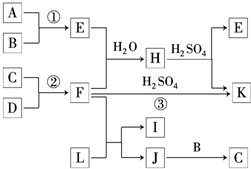 如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).已知:
如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).已知:(a)A、B、C、D都是非金属单质,其中B、C、D在常温常压下是气体.
(b)反应①、②是化工生产中的重要反应.
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.
(e)化合物J由两种元素组成,它是火箭推进剂的成分之一,其相对分子质量为32.
请按要求填空:
(1)反应③的化学方程式
2NH3+H2SO4═(NH4)2SO4
2NH3+H2SO4═(NH4)2SO4
.(2)C的结构式
N≡N
N≡N
;H的化学式(NH4)2SO3或NH4HSO3
(NH4)2SO3或NH4HSO3
.(3)L的溶液与化合物E反应的离子方程式:
ClO-+SO2+2OH-═Cl-+SO42-+H2O或ClO-+SO2+H2O═Cl-+SO42-+2H+
ClO-+SO2+2OH-═Cl-+SO42-+H2O或ClO-+SO2+H2O═Cl-+SO42-+2H+
.(4)化合物J的化学式
N2H4
N2H4
.如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;

请完成下列填空:
(1)H的化学式
(2)A与B 在加热条件下反应的主要现象是
(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为
查看习题详情和答案>>

请完成下列填空:
(1)H的化学式
NH4Cl
NH4Cl
;其晶体中所含化学键类型为离子键、共价键
离子键、共价键
;检验H 中阳离子的方法是取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.(2)A与B 在加热条件下反应的主要现象是
剧烈反应,火焰为黄色,生成淡黄色的固体
剧烈反应,火焰为黄色,生成淡黄色的固体
;F和H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;写出G溶液中加入过量的I溶液反应的离子方程式CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
.(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为
N2+3H2 2NH3
2NH3
 2NH3
2NH3N2+3H2 2NH3
2NH3
.反应开始至2min,用J表示的平均反应速率为 2NH3
2NH30.05mol/L?min
0.05mol/L?min
.如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
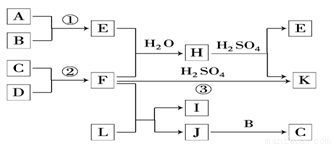
已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.
(b)反应①、②是化工生产中的重要反应.
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.
(e)化合物J由两种元素组成,其相对分子质量为32.
请按要求填空:
(1)反应③的化学方程式_____________________.
(2)C的结构式__________________________;
H为正盐,则H的化学式为____________________.
(3)L的溶液与化合物E反应的离子方程式: ______________.
(4)化合物J的化学式____________________.
查看习题详情和答案>>