网址:http://m.1010jiajiao.com/timu3_id_81280[举报]
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲2.33g,且甲不溶于稀盐酸.
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.112L(标准状况),乙能使湿润的红色石蕊试纸变蓝.
据此回答:
(1)写出R和甲的化学式:R
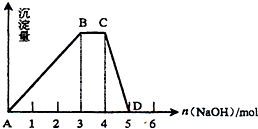
(2)另取1L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示.则:
①R溶液的物质的量浓度为
②BC段表示的含义是
③CD段反应的离子方程式为
盐R的化学式为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲2.33g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.112L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R ,甲 ,
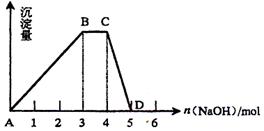 (2)另取1L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
(2)另取1L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
①R溶液的物质的量浓度为 ;
②BC段表示的含义是 ;
③CD段反应的离子方程式为 。
![]() 学科网
学科网
I.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲2.33 g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.112 L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R___,甲____。
(2)另取1 LR的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入NaOH的物质的量关系如图所示。则:

②BC段表示的含义是____。
③CD段反应的离子方程式为____。
盐R的化学式为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲4.66g,且甲不溶于稀盐酸;
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝。据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
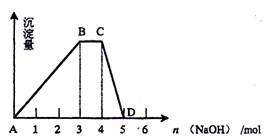
①B点处溶液中离子浓度从大到小的顺序是 。
②R溶液的物质的量浓度为 。
③BC段表示的含义是 。
④CD段表示的含义是 。
查看习题详情和答案>>①准确称取4.02g样品加热到失去全部结晶水,冷却后称量,质量为2.94g.
②将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量Ba(NO3)2溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为4.66g.
③向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40g.
请通过计算回答下列问题:
(1)确定R的化学式.R的化学式为
(2)B元素的名称是
(3)求x、y、z的值:x=
(4)A元素的名称是
(5)该复盐的化学式为