题目内容
盐R的化学式为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲2.33g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.112L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R ,甲 ,
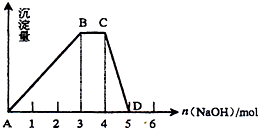
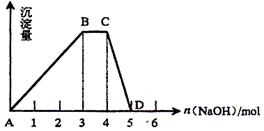 (2)另取1L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
(2)另取1L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
①R溶液的物质的量浓度为 ;
②BC段表示的含义是 ;
③CD段反应的离子方程式为 。
![]() 学科网
学科网
(1)NH4Al(SO4)2 , BaSO4 (2)①1mol/L![]() 学科网
学科网
②NH4+与OH-生成NH3·H2O ③Al(OH)3+OH- = AlO2- + 2H2O……(每空2分)
解析:
本题考查离子的推断及图象分析的计算题,属中档题。(1)由实验I分析,加入Ba(OH)2溶液,先沉淀再减少,显然是Al3+与OH-的反应。沉淀甲不溶于稀盐酸,不难推理为BaSO4,即R中含有SO42 -;实验II,加碱能生成气体,且能使湿润的红色石蕊试纸变蓝,说明是NH4+ ,故R的化学式为NH4Al(SO4)2 。
(2)向NH4Al(SO4)2 中加入碱,先生成Al(OH)3沉淀,然后是NH4+ 与OH-生成NH3,最后溶解Al(OH)3沉淀。不可能先生成NH3,因为产生的NH3仍会沉淀Al3+,也不可能先溶解沉淀,否则溶解生成的AlO2- 会与NH4+ 发生水解反应生成Al(OH)3沉淀。由题意知,5ml可产生0.112L的气体,故1L可产生1molNH3,由图象知,产生NH3所需的NaOH为1mol,C(R)·V(R)=1,故C(R)=1mol/L。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案