网址:http://m.1010jiajiao.com/timu3_id_81226[举报]
根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式:________.
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是________mol.
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是________.
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.有n个H-H键断裂的同时有2n个H-I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是________.
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A.
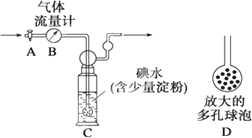
①用碘水测定SO2的含量的化学方程式是________.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________.
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”).
(1)写出Z的气态氢化物的结构式


(2)写出用惰性电极电解Cu(XY3)2溶液的离子反应方程式
| ||
| ||
(3)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究ZY2和W2的性质.
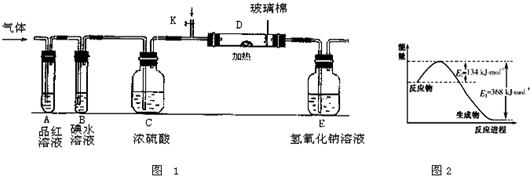
①分别通入ZY2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移的电子为5.0×10-5mol,则该反应的化学方程式为
(4)某同学将足量的ZY2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(5)图2是1molXO2和1molCO反应生成CO2和XO过程中能量变化示意图,请写出XO2和CO反应的热化学方程式
(6)盐酸肼(X2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与XH4Cl类似.
写出盐酸肼第一步水解反应的离子方程式
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。

(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:

①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”=;
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
H2(g)+O2(g) 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
N2(g)+2O2(g) 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
查看习题详情和答案>>
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。

(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:

①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
①2H2(g)+O2(g) 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
③N2(g)+3H2(g) 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
查看习题详情和答案>>
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。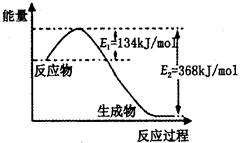
(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g)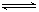 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表: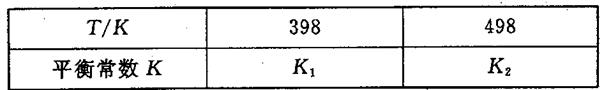
①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
①2H2(g)+O2(g)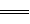 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
②N2(g)+2O2(g)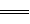 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
③N2(g)+3H2(g)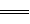 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。