摘要:062 5 mol 操作②:盐酸滴入纯碱中.发生反应: Na2CO3+HCl===NaCl+NaHCO3(1) NaHCO3+HCl===NaCl+CO2↑+H2O(2) 则反应(1)消耗盐酸:0.100 L×1.00 mol·L-1=0.100 mol 生成0.100 mol NaHCO3.过量盐酸与NaHCO3反应生成
网址:http://m.1010jiajiao.com/timu3_id_81202[举报]
有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

(1)在原溶液中一定不存在的离子有
(2)第③个实验中,若取原溶液的体积为100mL,滴加的NaOH溶液的物质的量浓度为0.5mol?L-1 且生成白色沉淀的量与加入NaOH 的量有下图所示的相互关系,则该溶液中所含阳离子的物质的量浓度为

查看习题详情和答案>>

(1)在原溶液中一定不存在的离子有
Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-
Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-
;(2)第③个实验中,若取原溶液的体积为100mL,滴加的NaOH溶液的物质的量浓度为0.5mol?L-1 且生成白色沉淀的量与加入NaOH 的量有下图所示的相互关系,则该溶液中所含阳离子的物质的量浓度为
c(Al3+)=0.5 mol?L-1 c(Mg2+)=0.2 mol?L-1
c(Al3+)=0.5 mol?L-1 c(Mg2+)=0.2 mol?L-1
mol?L-1.
髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题:
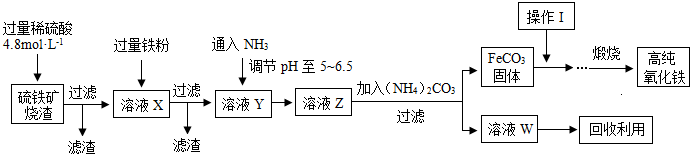
(1)过滤操作中的玻璃仪器为 .
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为 .
(3 )溶液X发生反应的离子方程式为 .
(4)简述如何检验溶液Z中的阴离子 .
(5)操作I的名称是 .列举W的一种用途 .
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示) .
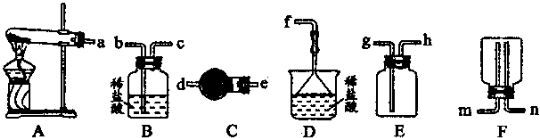
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论 .
查看习题详情和答案>>

(1)过滤操作中的玻璃仪器为
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为
(3 )溶液X发生反应的离子方程式为
(4)简述如何检验溶液Z中的阴离子
(5)操作I的名称是
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)

(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的过程如图所示:

请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①
(3)提取碘的过程中,不能使用的有机溶剂是
A.酒精 B.苯 C.汽油
该提取操作通常在
(4)设计一个简单的实验,检验提取碘后的水溶液中是否还含有单质碘.请写出该实验的实验步骤、现象及结论
(5)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碘元素的化合价是
测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
①配平上述方程式,配平后的系数为:
②实验中,若测得生成3.0×10-5 mol I2,则该食盐中碘元素的含量是
查看习题详情和答案>>

请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是
BDEF
BDEF
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①
过滤
过滤
、②萃取(分液)
萃取(分液)
.(3)提取碘的过程中,不能使用的有机溶剂是
A
A
.其原因是酒精与水互溶
酒精与水互溶
.A.酒精 B.苯 C.汽油
该提取操作通常在
分液漏斗
分液漏斗
(仪器名称)中进行,若得到的是含碘的四氯化碳溶液,静置后分层,下层为紫(红)色
紫(红)色
色.(4)设计一个简单的实验,检验提取碘后的水溶液中是否还含有单质碘.请写出该实验的实验步骤、现象及结论
取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质
取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质
.(5)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碘元素的化合价是
+5
+5
.测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
1
1
KIO3+5
5
KI+3
3
H2SO4→3
3
K2SO4+3
3
I2+3
3
H2O①配平上述方程式,配平后的系数为:
1、5、3、3、3、3
1、5、3、3、3、3
.还原剂是KI
KI
.②实验中,若测得生成3.0×10-5 mol I2,则该食盐中碘元素的含量是
25.4
25.4
mg/kg.(精确至0.1)