题目内容
有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

(1)在原溶液中一定不存在的离子有
(2)第③个实验中,若取原溶液的体积为100mL,滴加的NaOH溶液的物质的量浓度为0.5mol?L-1 且生成白色沉淀的量与加入NaOH 的量有下图所示的相互关系,则该溶液中所含阳离子的物质的量浓度为


(1)在原溶液中一定不存在的离子有
Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-
Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-
;(2)第③个实验中,若取原溶液的体积为100mL,滴加的NaOH溶液的物质的量浓度为0.5mol?L-1 且生成白色沉淀的量与加入NaOH 的量有下图所示的相互关系,则该溶液中所含阳离子的物质的量浓度为
c(Al3+)=0.5 mol?L-1 c(Mg2+)=0.2 mol?L-1
c(Al3+)=0.5 mol?L-1 c(Mg2+)=0.2 mol?L-1
mol?L-1.
分析:(1)根据题干信息“无色溶液”可以判定,一定没有有色离子:Fe3+、Fe2+、Cu2+; 由①可知一定没有K+;②中加稀盐酸和氯化钡溶液仍有沉淀,可知一定存在SO42-;③可以推断一定含有Mg2+.由于,Mg2+和 CO32- 不能共存,所以一定没有 CO32-;④中得到无色无味的气体,可以判定一定没有NH4+
(2)由图中信息,加入Vml0.5mol?L-1NaOH溶液,沉淀达到最多,再滴加100mlNaOH溶液后,沉淀部分溶解,可知0.07mol沉淀为Mg(OH)2和Al(OH)3的混物,其中c(Al3+)=c(OH-)=0.5×0.1=0.05mol,故c(Al3+)=0.05mol÷0.1L=0.5 mol?L-1;根据n(Mg(OH)2)+n(Al(OH)3)=0.07mol,可以得到n(Mg(OH)2)=0.02mol,c(Mg2+)=0.02mol÷0.01L=0.2 mol?L-1
(2)由图中信息,加入Vml0.5mol?L-1NaOH溶液,沉淀达到最多,再滴加100mlNaOH溶液后,沉淀部分溶解,可知0.07mol沉淀为Mg(OH)2和Al(OH)3的混物,其中c(Al3+)=c(OH-)=0.5×0.1=0.05mol,故c(Al3+)=0.05mol÷0.1L=0.5 mol?L-1;根据n(Mg(OH)2)+n(Al(OH)3)=0.07mol,可以得到n(Mg(OH)2)=0.02mol,c(Mg2+)=0.02mol÷0.01L=0.2 mol?L-1
解答:解:(1)根据题干信息“无色溶液”可以判定,一定没有有色离子:Fe3+、Fe2+、Cu2+;由①焰色反应可知一定没有K+;+;②中加稀盐酸和氯化钡溶液仍有沉淀,可知一定存在SO42-;③可以推断一定含有Mg2+.由于,Mg2+和 CO32- 不能共存,所以一定没有 CO32-;④中得到无色无味的气体,可以判定一定没有NH4+; 综合以上分析,故答案为:Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-;
(2)由图中信息,加入Vml0.5mol?L-1NaOH溶液,沉淀达到最多,再滴加100mlNaOH溶液后,沉淀部分溶解,可知0.07mol沉淀为Mg(OH)2和Al(OH)3的混物,其中c(Al3+)=c(OH-)=0.5×0.1=0.05mol,故c(Al3+)=0.05mol÷0.1L=0.5 mol?L-1;根据n(Mg(OH)2)+n(Al(OH)3)=0.07mol,可以得到n(Mg(OH)2)=0.02mol,c(Mg2+)=0.02mol÷0.01L=0.2 mol?L-1,故答案为 c(Al3+)=0.5 mol?L-1; c(Mg2+)=0.2 mol?L-1
(2)由图中信息,加入Vml0.5mol?L-1NaOH溶液,沉淀达到最多,再滴加100mlNaOH溶液后,沉淀部分溶解,可知0.07mol沉淀为Mg(OH)2和Al(OH)3的混物,其中c(Al3+)=c(OH-)=0.5×0.1=0.05mol,故c(Al3+)=0.05mol÷0.1L=0.5 mol?L-1;根据n(Mg(OH)2)+n(Al(OH)3)=0.07mol,可以得到n(Mg(OH)2)=0.02mol,c(Mg2+)=0.02mol÷0.01L=0.2 mol?L-1,故答案为 c(Al3+)=0.5 mol?L-1; c(Mg2+)=0.2 mol?L-1
点评:本题考查了焰色反应、常见的有色离子、离子的水解、离子反应的条件,Al(OH)3的化学性质,涉及的知识点较多,若是基础知识不扎实,恐怕难以完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 所示的相互关系。据此可知:
所示的相互关系。据此可知:


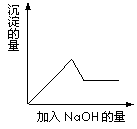 第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
 所示的相互关系。据此可知:
所示的相互关系。据此可知: