摘要:16.X.Y.Z三种短周期元素.它们的原子序数之和为16.X.Y.Z三种元素常见单质在常温下都是无色气体.在适当条件下可发生如右图所示的变化: 已知一个B分子中含有的Z元素的原子个数比C分子中的少一个. 请回答下列问题: (1)X元素在元素周期表中的位置是 . (2)X的单质与Z的单质可制成新型的化学电源.两个电极均由多孔性碳制成.通入的气体由孔隙中逸出.并在电极表面放电.则正极通入 ,负极电极反应式为 . (3)C在一定条件下反应生成A的化学方程式是 . (4)X.Y.Z三种元素可组成一种强酸W.C在适当条件下被W溶液吸收生成一种盐.该盐的水溶液的pH 7(填“大于 “小于 或“等于 ).其原因是: . (5)已知Y的单质与Z的单质生成C的反应是可逆反应.ΔH<0.将等物质的量的Y.Z的单质充入一密闭容器中.在适当催化剂和恒温.恒压条件下反应.下列说法中.正确的是 . a.达到化学平衡时.正反应速率与逆反应速率相等 b.反应过程中.Y的单质的体积分数始终为50% c.达到化学平衡时.Y.Z的两种单质在混合气体中的物质的量之比为1∶1 d.达到化学平衡的过程中.混合气体平均相对分子质量减小 e.达到化学平衡后.再升高温度.C的体积分数增大 解析:除惰性气体外.短周期的无色气体只有H2.N2.O2.由此不难确定X为O.Y为N.Z为H. (5)设反应开始一段时间后生成NH3 x mol. N2 + 3H22NH3 反应前 a mol a mol 0 反应后 a- a-x x 则反应后N2的体积分数为=50%. 答案:氧气 H2+2OH--2e-―→2H2O (3)4NH3+5O2高温催化剂4NO+6H2O (4)小于 NH+H2ONH3·H2O+H+ (5)ab
网址:http://m.1010jiajiao.com/timu3_id_81159[举报]
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
第2周期VIA族
第2周期VIA族
.(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
氢键
氢键
.(3)①C在一定条件下反应生成A的化学方程式是
4NH3+5O2=4NO+6H2O
4NH3+5O2=4NO+6H2O
.②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH
小于
小于
7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的有
ad
ad
.a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大.
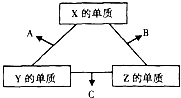 X、Y、Z三种短周期元素,它们的原子序数之和为16.在常温下,X、Y、Z三种元素的常见单质都是无色气体,它们在适当条件下可发生如图所示的转化.已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,它们的原子序数之和为16.在常温下,X、Y、Z三种元素的常见单质都是无色气体,它们在适当条件下可发生如图所示的转化.已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数少一个.请回答下列问题:(1)X元素在周期表中的位置是
第二周期VIA族
第二周期VIA族
.Y的原子序数为7
7
.(2)X的单质与Z的单质可制成新型的化学电源,该电源被称为
氢氧燃料电池
氢氧燃料电池
.(3)A的化学式为
NO
NO
.(4)已知Y的单质与Z的单质在适当催化剂和高温、高压条件下,生成C的反应是可逆反应,写出该反应的化学方程式
N2+3H2
2NH3
| 高温、高压 |
| 催化剂 |
N2+3H2
2NH3
.| 高温、高压 |
| 催化剂 |
X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:

已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒.
请回答下列问题:
(1)X元素在周期表中的位置是
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为
(3)化合物B吸收C后形成的溶液pH
(4)写出由C生成A和B的化学方程式
查看习题详情和答案>>

已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒.
请回答下列问题:
(1)X元素在周期表中的位置是
第二周期第ⅥA族
第二周期第ⅥA族
.(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为
H2+2OH--2e-═2H2O
H2+2OH--2e-═2H2O
.(3)化合物B吸收C后形成的溶液pH
>
>
7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.(4)写出由C生成A和B的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示变化:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个,B、C两种分子中的电子数均等于10.下列说法错误的是( )

查看习题详情和答案>>
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图1变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
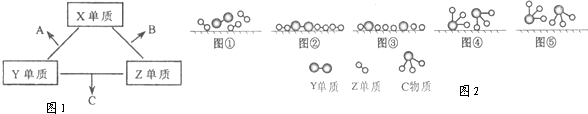
(1)X元素在周期表中的位置是 周期, 族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们 .
(3)C的电子式是 ; Z单质与Y单质在固体催化剂表面合成C的反应过程,示意如图2.
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是 .
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K= ;用物质C表示该反应的反应速率为 .
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式 .用该反应合成1mol液态甲醇吸收热量131.9kJ,
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式 .
查看习题详情和答案>>

(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们
(3)C的电子式是
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K=
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式
