摘要:6.标准状况下.某同学向100 mL H2S饱和溶液中通入SO2.所得溶液 pH变化如图所示.下列分析中.正确的是 ( ) A.ab段反应是:SO2+2H2S===3S↓+2H2O B.亚硫酸是比氢硫酸更弱的酸 C.原H2S溶液的物质的量浓度为0.05 mol·L-1 D.b点对应的溶液导电性最强 解析:本题考查SO2的性质.H2S具有还原性.SO2具有氧化性.二者发生反应:2H2S +SO2===2H2O+3S↓.A对,a处为H2S溶液.d处为H2SO3溶液.可以判断亚 硫酸酸性比氢硫酸强.B错,根据2H2S+SO2===2H2O+3S↓.由于通入112 mL SO2 时pH=7.则n(SO2)=2n(SO2)=2×=0.01 mol.故c(H2S)==0.1 mol/L.C错,b点pH=7.为纯水.导电性最弱.D错. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_81048[举报]
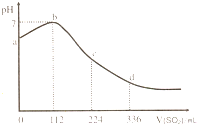 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )。

A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看习题详情和答案>>
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
