摘要:8.金属陶瓷是一种广泛应用于高科技的复合材料.合成方法是将陶瓷(主要成分为Al2O3.ZnO2等耐高温材料)和黏结金属(主要是Cr.Mo.W.Ti等高熔点金属)研磨混匀成型后.高温烧结使金属仍然以单质的形式存在于金属陶瓷之中.据此判断合成工艺必须 ( ) A.在氧气中合成 B.在HCl气氛中合成 C.在氮气气氛中合成 D.在空气中合成 解析:由题给信息“高温烧结使金属仍然以单质的形式存在 知C正确.其他三个选项所列举的反应条件均会使黏结金属以化合物的形式存在.如在高温下氧气与金属反应生成氧化物.在HCl气氛中金属变成氯化物. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_81020[举报]
(2012?太原一模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
(CuCl2?2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
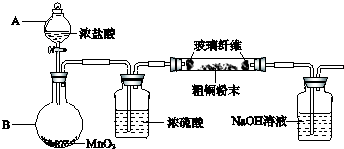
①仪器A的名称是
②装置B中发生反应的离子方程式是
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=
.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
查看习题详情和答案>>
(CuCl2?2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).

①仪器A的名称是
分液漏斗
分液漏斗
.②装置B中发生反应的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
否
否
.(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
cd
cd
.a.NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq)
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)蓝色 黄色
①上述反应的化学平衡常数表达式是K=
c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
不变
不变
.②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)
abc
abc
.a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2?2H2O).
(1)为了完成步骤Ⅰ,可采用如下图所示的装置将粗铜转化为固体a.
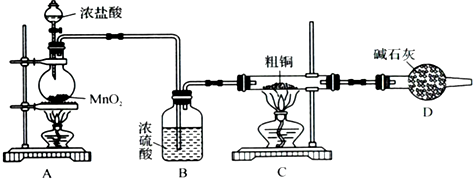
在该实验中,加热A、C装置中的酒精灯时,应该先点燃 装置的酒精灯,D装置的作用是 ,C装S中生成的产物是 .
(2)步骤Ⅱ中的操作是:将步骤Ⅰ中的固体加入到容器中,然后加入 ,固体完全溶解.
(3)步骤Ⅲ中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式: .
(4)步骤Ⅳ中应先加入某试剂,然后过滤得到滤液.为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是 .
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O晶体.现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2?2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是 .
查看习题详情和答案>>
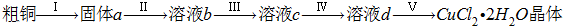
(1)为了完成步骤Ⅰ,可采用如下图所示的装置将粗铜转化为固体a.

在该实验中,加热A、C装置中的酒精灯时,应该先点燃
(2)步骤Ⅱ中的操作是:将步骤Ⅰ中的固体加入到容器中,然后加入
(3)步骤Ⅲ中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式:
(4)步骤Ⅳ中应先加入某试剂,然后过滤得到滤液.为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O晶体.现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2?2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按如图1所示流程制备氯化铜晶体(CuCl2?2H20).
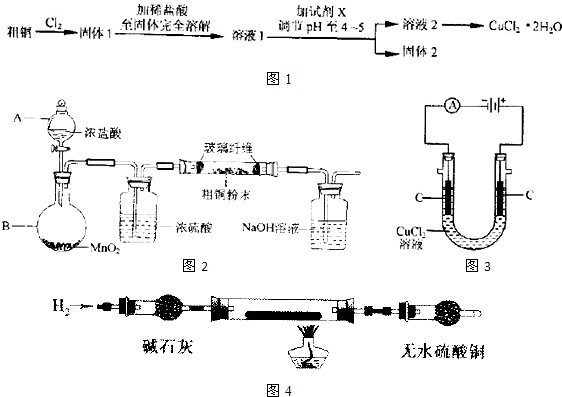
(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
(2)试剂X用以除去杂质,X可选用下列试剂中的
a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
②电解CuCl2溶液时,阴极发生反应的电极方程式为
查看习题详情和答案>>

(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
否
否
(填“是”或“否”).(2)试剂X用以除去杂质,X可选用下列试剂中的
cd
cd
(填序号).a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
不变
不变
.②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
abc
abc
.a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
2CuCl+H2
2Cu+2HCl
| ||
2CuCl+H2
2Cu+2HCl
.
| ||
②电解CuCl2溶液时,阴极发生反应的电极方程式为
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
.(2013?德州二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2?xH2O).

(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去).该装置中仪器a的名称是

(2)操作Ⅱ中应控制的pH范围为
已知:
(3)操作Ⅲ的程序依次为
(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是
查看习题详情和答案>>

(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去).该装置中仪器a的名称是
分液漏斗
分液漏斗
.装置b中发生反应的离子方程式是MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.该装置存在一定的安全隐患,消除该安全隐患的措施是
| ||
间连接一个防止倒吸的装置;
间连接一个防止倒吸的装置;
.
(2)操作Ⅱ中应控制的pH范围为
3.2≤PH<4.7
3.2≤PH<4.7
,其目的是使氯化铁转化为氢氧化铁沉淀从而与氯化铜分离(或者除去氯化铜溶液中的氯化铁)
使氯化铁转化为氢氧化铁沉淀从而与氯化铜分离(或者除去氯化铜溶液中的氯化铁)
.已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH | |
| Cu2+ Fe2+ Fe3+ |
4.7 4.0 1.9 |
6.7 9.0 3.2 |
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤、自然干燥.得到CuCl2?xH2O晶体.(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是
与粗铜反应的氯气不足量
与粗铜反应的氯气不足量
,试提出两种不同的改进方案:①通入足量的氯气
通入足量的氯气
;②在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气
在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气
.氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。

(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
A. NaOH B. NH3.H2O C. CuO D..Cu(OH)2 E. CuSO4
(3)滤液B经一系列操作可得氯化铜晶体,操作的程序依次为_________ 、_________、 过滤、自然干燥。
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。
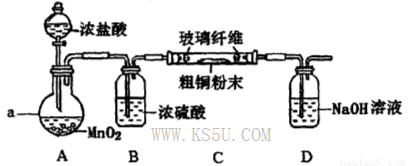
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。
查看习题详情和答案>>