题目内容
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2?2H2O).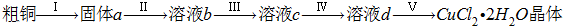
(1)为了完成步骤Ⅰ,可采用如下图所示的装置将粗铜转化为固体a.
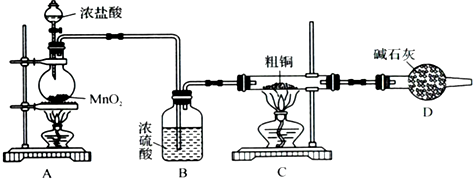
在该实验中,加热A、C装置中的酒精灯时,应该先点燃
(2)步骤Ⅱ中的操作是:将步骤Ⅰ中的固体加入到容器中,然后加入
(3)步骤Ⅲ中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式:
(4)步骤Ⅳ中应先加入某试剂,然后过滤得到滤液.为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O晶体.现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2?2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是
分析:(1)为了防止金属和氧气之间的反应,在金属参与反应之前先将装置中的空气排净,氯气可以和金属之间反应,氯气有毒,要进行尾气处理;
(2)根据金属铜和金属铁化学性质的区别进行回答;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水;
(5)在氯化铜溶液中,铜离子水解导致溶液显示酸性,盐酸环境可以抑制其水解的发生.
(2)根据金属铜和金属铁化学性质的区别进行回答;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水;
(5)在氯化铜溶液中,铜离子水解导致溶液显示酸性,盐酸环境可以抑制其水解的发生.
解答:解:(1)为了防止金属Fe、Cu和氧气之间的反应,在金属和氯气的反应之前要先产生氯气,先将装置中的空气排净,氯气和金属之间反应,得到的是高价金属氯化物,氯气有毒,可以用碱石灰进行尾处理,故答案为:A;吸收尾气,防止污染空气;CuCl2、FeCl3;
(2)金属铜不可以和盐酸之间反应但是金属铁可以,向金属混合物中加入盐酸、过滤可以将金属铜、铁分离,故答案为:稀盐酸;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水,即H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水,加入试剂CuO粉末调节溶液的pH使Fe3+完全沉淀,若用氨水或NaOH溶液,会防止引进杂质,且试剂的量不易控制,故答案为:加入氨水或是氢氧化钠溶液会引进杂质,且试剂的量不易控制;
(5)CuCl2?2H2O脱水得到无水CuCl2,应该是在氯化氢气流中进行的,目的是抑制铜离子水解,所以A装置是氯化氢的发生装置,装置内装的是氯化钠晶体和浓硫酸,故答案为:氯化钠晶体和浓硫酸.
(2)金属铜不可以和盐酸之间反应但是金属铁可以,向金属混合物中加入盐酸、过滤可以将金属铜、铁分离,故答案为:稀盐酸;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水,即H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水,加入试剂CuO粉末调节溶液的pH使Fe3+完全沉淀,若用氨水或NaOH溶液,会防止引进杂质,且试剂的量不易控制,故答案为:加入氨水或是氢氧化钠溶液会引进杂质,且试剂的量不易控制;
(5)CuCl2?2H2O脱水得到无水CuCl2,应该是在氯化氢气流中进行的,目的是抑制铜离子水解,所以A装置是氯化氢的发生装置,装置内装的是氯化钠晶体和浓硫酸,故答案为:氯化钠晶体和浓硫酸.
点评:本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目



 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
