摘要:4.氧化还原滴定法是以氧化还原反应为基础的滴定分析方法.其中有一种叫高锰酸钾法.由于在微酸.中性或弱碱性溶液中. MnO4-被还原为棕色不溶物MnO2.使溶液混浊而妨碍滴定终点的观察.因此高锰酸钾法通常在较强的酸性溶液中进行. (1)酸化高锰酸钾溶液时.能不能使用盐酸? .理由是(回 答“不能 .用离子方程式表示,回答“能 此空不填): ,能否使用HNO3? 理由是: . (2)KMnO4标准溶液常用还原物质来标定.常用的还原物质为Na2C2O4等.其标定反应如下: MnO4-+ C2O42-+ H+=== Mn2++ CO2↑+ H2O 请配平以上化学方程式. (3)用KMnO4标准溶液在酸性溶液中可测定H2O2样品中H2O2的含量.反应如下:2MnO4-+5H2O2+6H+===2Mn2++5O2↑+8H2O. ①滴定开始时.是否需要滴加指示剂? .理由是 . ②反应开始较慢.随着反应的进行.反应速度明显加快.原因是 . 解析: 答案:(1)不能 2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O 不能 HNO3具有强氧化性.会氧化待滴定溶液中的溶质 (2)2MnO4-+5C2O42-+16H+===2Mn2++10CO2↑+8H2O (3)①否 MnO4-本身为紫红色.到达滴定终点时.变为无色的Mn2+ ②随着反应的进行.起催化作用的Mn2+不断增多.故反应速率明显加快 考点2 离子反应规律.离子方程式正误判断.离子能否大量共存的判断
网址:http://m.1010jiajiao.com/timu3_id_80988[举报]
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)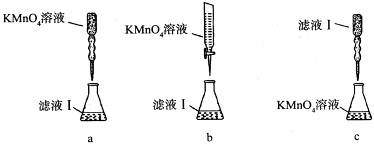
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。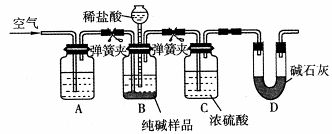
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
氧化亚铜(Cu2O)是不溶于水的碱性氧化物,能溶于酸发生自身氧化还原反应生成单质铜和Cu2+。测定一种含氧化亚铜的矿石中氧化亚铜的含量的方法是:将矿石溶于足量的硫酸铁和硫酸的混合液中,然后用高锰酸钾溶液滴定,反应后锰元素以+2价形式存在。
(1)写出配平的化学反应方程式。
①Cu2O与Fe2(SO4)3、H2SO4反应为____________________。
②滴加高锰酸钾溶液时发生的反应为________________________。
(2)Cu2O与上述两反应中氧化剂的氧化性强弱顺序是_____________________。
(3)若某次测定中称取5.0g矿样,用高锰酸钾溶液滴定时,消耗0.1mol·L-1 KMnO4的体积为100mL,则矿样中氧化亚铜的质量分数为_____________。
查看习题详情和答案>>
(1)写出配平的化学反应方程式。
①Cu2O与Fe2(SO4)3、H2SO4反应为____________________。
②滴加高锰酸钾溶液时发生的反应为________________________。
(2)Cu2O与上述两反应中氧化剂的氧化性强弱顺序是_____________________。
(3)若某次测定中称取5.0g矿样,用高锰酸钾溶液滴定时,消耗0.1mol·L-1 KMnO4的体积为100mL,则矿样中氧化亚铜的质量分数为_____________。
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)

(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。
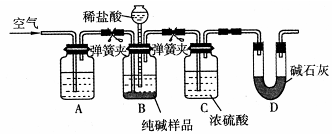
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)

(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。

①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
;(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是
H2+O2
H2O2
| ||
H2+O2
H2O2
.
| ||
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/℃ | H2O2初始浓度/ mol?L-1 |
FeCl3初始浓度/ mol?L-1 |
| Ⅰ | 20 | 1.0 | 0 0 |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | 1.0 1.0 |
0.1 |
0
0
mol?L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0
1.0
mol?L-1.②三组实验中分解速率最快的是
Ⅲ
Ⅲ
(填编号).Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol?L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2
(4)滴定到达终点的现象是
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
.(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
0.1800
0.1800
mol?L-1.(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果
偏高
偏高
(“偏高”或“偏低”或“不变”).二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
查看习题详情和答案>>
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑
Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑
.(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
H2SO4(浓)>SeO2>SO2
H2SO4(浓)>SeO2>SO2
.(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
55.5%
55.5%
.