摘要:15.已知水在25℃和95℃时.其电离平衡曲线如下图所示: (1)则25℃时水的电离平衡曲线应为 .请说明理由 . (2)25℃时.将pH=9的NaOH溶液与pH=4的H2SO4溶液混合.若所得混合溶液的pH=7.则NaOH溶液与H2SO4溶液的体积比为 . (3)95℃时.若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性.则混合前.该强酸的pH1与强碱的pH2之间应满足的关系是 . (4)曲线B对应温度下.pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后.混合溶液的pH=5.请分析其原因: . 解析:本题的关键是搞清楚温度对水的电离平衡.水的离子积和溶液pH的影响. (1)当温度升高时.促进水的电离.水的离子积也增大.水中氢离子浓度.氢氧根离子浓度都增大.水的pH变小.但溶液仍然呈中性.因此结合图像中A.B曲线变化情况及氢离子浓度.氢氧根离子浓度可以判断.25℃时水的电离平衡曲线应为A.理由为水的电离是吸热过程.升高温度.水的电离程度增大. (2)25℃时所得混合溶液的pH=7.溶液呈中性即酸碱恰好中和.即n(OH-)=n(H+).则V·10-5 mol/L=V(H2SO4)·10-4 mol/L.得V∶V(H2SO4)=10∶1. (3)要注意是95℃时.水的离子积为10-12.即c(H+)·c(OH-)=10-12 mol2·L-2.即:等体积强酸强碱反应至中性时pH=12.根据95℃时混合后溶液呈中性.pH2=b的某强碱溶液中c(OH-)=10b-12,有100×10-a=1×10b-12.即:10-a+2=10b-12.所以.有以下关系:a+b=14或pH1+pH2=14. (4)在曲线B对应温度下.因pH=12.可得酸碱两溶液中c(H+)=c(OH-).如是强酸.强碱.两溶液等体积混合后溶液应呈中性,现混合溶液的pH=5.即等体积混合后溶液显酸性.说明H+与OH-完全反应后又有新的H+产生.即酸过量.所以说酸HA是弱酸. 答案:(1)A 水的电离是吸热过程.温度低时.电离程度较小.c(H+).c(OH-)较小 a+b=14或pH1+pH2=14 (4)曲线B对应95℃.此时水的离子积为10-12 mol2·L-2.HA为弱酸.HA中和NaOH后.混合溶液中还剩余较多的HA分子.可继续电离出H+.使溶液pH=5.
网址:http://m.1010jiajiao.com/timu3_id_80511[举报]
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
A
A
;(填“A”或“B”),请说明理由水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
;(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
1:9
1:9
;曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL0.3mol/L的NaOH溶液混合,求混合后溶液的pH=11
11
;(3)25℃时,将PH=13的NaOH溶液l0mol逐滴滴入PH=1的CH3COOH溶液10ml中,反应后溶液的pH
<
<
7(填“>”、“<”或“=”).(4)-50℃时,液氨存在如下电离:2NH3?NH4++NH2-,K=2×10-12,往液氨中加入NH4C1固体,K
=
=
2×10-12(填“<”、“>”或“=”) 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)25°C时,水的电离平衡曲线应为哪一条?请说明理由
A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
(2)95°C时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为为多少?
(3)95°C时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是?
(4)曲线B对应的温度下,pH=2的某酸HA与pH=10的NaOH溶液等体积混合后,溶液的pH=5,请分析其原因
曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+
曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+
.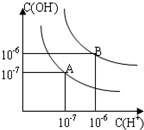 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
A
A
;(填“A”或“B”),请说明理由水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
;(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为
10:1
10:1
;曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL 0.3mol/L的NaOH溶液混合,求混合后溶液的pH11
11
;(3)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:
曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
;(4)25℃时,以酚酞为指示剂用0.1mol/L的NaOH标准溶液滴定未知浓度的HCl溶液,则:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则HCl溶液浓度
偏高
偏高
(填“偏高”、“偏低”或“无影响”).②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
无影响
无影响
.(填“偏大”、“偏小”或“无影响”)③当达到滴定终点时现象
溶液颜色由无色变为红色,且半分钟不褪色
溶液颜色由无色变为红色,且半分钟不褪色
.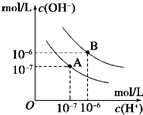 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )| A、A曲线代表25℃时水的电离平衡曲线 | B、当95℃时,pH=6的溶液呈中性 | C、25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4溶液混合,所得溶液的pH=7 | D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
已知水在25 ℃ 和95 ℃ 时,其电离平衡曲线如下图所示:
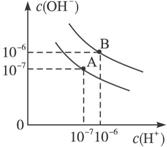
(1)则
② 。
(2)
(3)
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因: ⑤ 。
查看习题详情和答案>>