题目内容
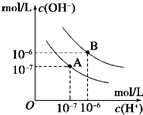 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )| A、A曲线代表25℃时水的电离平衡曲线 | B、当95℃时,pH=6的溶液呈中性 | C、25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4溶液混合,所得溶液的pH=7 | D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
分析:A.纵轴是氢氧根离子浓度,横轴是氢离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw值与25℃时比较判断;
B.溶液的酸碱性取决于氢离子与氢氧根离子浓度的相对大小,求出当95℃时,pH=6的溶液时氢氧根离子的浓度判断;
C.NaOH溶液与H2SO4溶液混合,发生酸碱中和反应,求出反应后溶液中的氢离子浓度,带入pH计算公式;
D.等体积等物质的量浓度的HA溶液和NaOH溶液恰好中和生成NaA盐溶液.若HA是弱酸,则NaA是强碱弱酸盐溶液显碱性;若HA是强酸,则NaA是强酸强碱盐不水解溶液显中性,据此解答.
B.溶液的酸碱性取决于氢离子与氢氧根离子浓度的相对大小,求出当95℃时,pH=6的溶液时氢氧根离子的浓度判断;
C.NaOH溶液与H2SO4溶液混合,发生酸碱中和反应,求出反应后溶液中的氢离子浓度,带入pH计算公式;
D.等体积等物质的量浓度的HA溶液和NaOH溶液恰好中和生成NaA盐溶液.若HA是弱酸,则NaA是强碱弱酸盐溶液显碱性;若HA是强酸,则NaA是强酸强碱盐不水解溶液显中性,据此解答.
解答:解:A.曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,所以A曲线代表25℃时水的电离平衡曲线,故A正确;
B.从图中数据可知95℃时,pH=6的溶液中C(OH-)=10-6=C(H+),所以该溶液显中性,故B正确;
C.25℃时,10mLpH=12中含氢氧根离子的物质的量为:n(OH-)=10×10-3L×10-2mol/L=10-4mol;
1mLpH=1的H2SO4溶液含氢离子的物质的量:n(H+)=1×10-3L×10-1mol/L=10-4mol,n(OH-)=n(H+),溶液呈中性,故C正确;
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液恰好生成NaA盐溶液,从曲线B可知该温度下当C(H+)=10-6时,溶液中的c(OH-)=10-6,所以C(OH-)=C(H+),溶液呈中性,说明NaA盐不水解,HA是强酸,故D错误;
故选D.
B.从图中数据可知95℃时,pH=6的溶液中C(OH-)=10-6=C(H+),所以该溶液显中性,故B正确;
C.25℃时,10mLpH=12中含氢氧根离子的物质的量为:n(OH-)=10×10-3L×10-2mol/L=10-4mol;
1mLpH=1的H2SO4溶液含氢离子的物质的量:n(H+)=1×10-3L×10-1mol/L=10-4mol,n(OH-)=n(H+),溶液呈中性,故C正确;
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液恰好生成NaA盐溶液,从曲线B可知该温度下当C(H+)=10-6时,溶液中的c(OH-)=10-6,所以C(OH-)=C(H+),溶液呈中性,说明NaA盐不水解,HA是强酸,故D错误;
故选D.
点评:本题考了水的离子积常数计算、溶液的酸碱性题目难度不大,注意弱酸的判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: (1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:
(1)写出下列物质溶于水的电离方程式①冰醋酸溶于水: 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: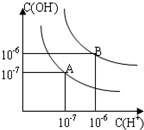 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: