题目内容
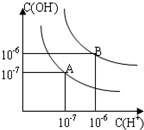 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
A
A
;(填“A”或“B”),请说明理由水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
;(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为
10:1
10:1
;曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL 0.3mol/L的NaOH溶液混合,求混合后溶液的pH11
11
;(3)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:
曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
;(4)25℃时,以酚酞为指示剂用0.1mol/L的NaOH标准溶液滴定未知浓度的HCl溶液,则:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则HCl溶液浓度
偏高
偏高
(填“偏高”、“偏低”或“无影响”).②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
无影响
无影响
.(填“偏大”、“偏小”或“无影响”)③当达到滴定终点时现象
溶液颜色由无色变为红色,且半分钟不褪色
溶液颜色由无色变为红色,且半分钟不褪色
.分析:(1)根据水的电离是吸热过程,升高温度,使水的电离程度增大分析;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;根据混合后溶液中氢氧根离子的浓度计算出该温度下氢离子浓度,再根据水的离子积计算出溶液的pH;
(3)根据曲线B对应温度下pH=5,说明溶液显示酸性,反应后氢离子过量分析;
(4)①根据滴定管没有润洗,导致待装液浓度减小分析;
②根据锥形瓶中有水,不影响待测液的物质的量分析;
③根据反应结束前,溶液为无色,反应结束后滴入氢氧化钠溶液,溶液显示红色分析.
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;根据混合后溶液中氢氧根离子的浓度计算出该温度下氢离子浓度,再根据水的离子积计算出溶液的pH;
(3)根据曲线B对应温度下pH=5,说明溶液显示酸性,反应后氢离子过量分析;
(4)①根据滴定管没有润洗,导致待装液浓度减小分析;
②根据锥形瓶中有水,不影响待测液的物质的量分析;
③根据反应结束前,溶液为无色,反应结束后滴入氢氧化钠溶液,溶液显示红色分析.
解答:解:(1)当温度升高时,促进水电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;因此结合图象中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断25℃时水的电离平衡曲线应为A,理由为水的电离是吸热过程,升高温度,使水的电离程度增大,
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)中25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1;
曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL 0.3mol/L的NaOH溶液混合,反应后溶液中的氢氧根离子浓度为c(OH-)=
=0.1mol/L,95℃时,水的离子积为:c(H+)?c(OH-)=10-12,所以溶液中氢离子浓度为:10-11mol/L,该温度下,溶液的pH为11,
故答案为:10:1;11;
(3)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸碱,两溶液等体积混合后溶液呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以酸HA是弱酸,
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5;
(4)①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,导致标准液的浓度减小,滴定时消耗的标准液的体积增大,则HCl溶液浓度偏高,故答案为:偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,对待测液氯化氢的物质的量没有影响,则滴定时用去NaOH标准溶液的体积无影响,故答案为:无影响;
③当达到滴定终点时现象,锥形瓶中溶液颜色由无色变为红色,且半分钟不褪色,
故答案为:溶液颜色由无色变为红色,且半分钟不褪色.
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)中25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1;
曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL 0.3mol/L的NaOH溶液混合,反应后溶液中的氢氧根离子浓度为c(OH-)=
| 0.3mol/L×0.25L-0.1mol/L×0.25L |
| 0.25L×2 |
故答案为:10:1;11;
(3)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸碱,两溶液等体积混合后溶液呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以酸HA是弱酸,
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5;
(4)①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,导致标准液的浓度减小,滴定时消耗的标准液的体积增大,则HCl溶液浓度偏高,故答案为:偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,对待测液氯化氢的物质的量没有影响,则滴定时用去NaOH标准溶液的体积无影响,故答案为:无影响;
③当达到滴定终点时现象,锥形瓶中溶液颜色由无色变为红色,且半分钟不褪色,
故答案为:溶液颜色由无色变为红色,且半分钟不褪色.
点评:本题考查了水的电离、水的离子积及溶液pH的简单计算,题目难度中等,解题关键是在搞清楚温度对水电离平衡、水的离子积和溶液pH的影响.

练习册系列答案
相关题目
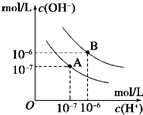 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )| A、A曲线代表25℃时水的电离平衡曲线 | B、当95℃时,pH=6的溶液呈中性 | C、25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4溶液混合,所得溶液的pH=7 | D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: (1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:
(1)写出下列物质溶于水的电离方程式①冰醋酸溶于水: 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: