网址:http://m.1010jiajiao.com/timu3_id_80049[举报]

填写下列空白:
(1)如何检查装置A的气密性:________________________。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是_____________
___________________。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是_______________________________________________________。
(4)用该法制得的晶体中往往混有Fe (NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成________________________________________。
(5)若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为__________(用含m、V的代数式表示),请在框图C中画出必要的装置。
查看习题详情和答案>>三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
填写下列空白:
(1)如何检查装置A的气密性: 。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是 。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由 。
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成 。
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用 (填序号),理由是 。
查看习题详情和答案>>
三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。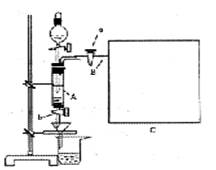
填写下列空白:
(1)如何检查装置A的气密性: 。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是 。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由 。
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成 。
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用 (填序号),理由是 。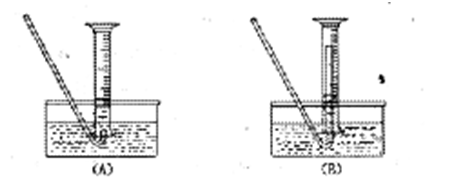
三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
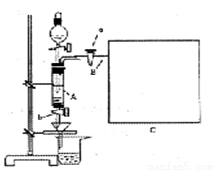
填写下列空白:
(1)如何检查装置A的气密性: 。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是 。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由 。
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成 。
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用 (填序号),理由是 。

查看习题详情和答案>>
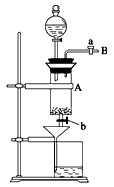
(2)滴加盐酸时,发现反应速率较盐酸与纯铁粉反应的要快,其原因是________________________。
(3)烧杯内盛放过量稀HNO3的原因是___________________,反应的离子方程式是_________________。
(4)整个实验过程中,旋塞a都必须打开,除了为排出产生的气体外,另一个目的是___________________________________。
(5)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是______________________。