网址:http://m.1010jiajiao.com/timu3_id_79384[举报]
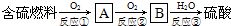
试回答下列问题:
(1)图中三个反应不属于氧化还原反应的是
(2)从保护环境的角度出发,工业上正努力从酸雨产生的根源出发进行治理,以减小酸雨的污染.方法一是将SO2中+4价硫元素变成0价硫元素,利用这一原理,可在工厂的烟道气中通入合适的
(3)火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为硫酸钙等.写出用CaCO3悬浊液洗涤上述废气的化学方程式:
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O).写出有关的化学反应方程式
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
| 催化剂 |
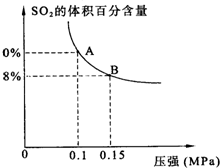
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:__________________________________________________。
②SO2与Ca(OH)2悬浊液反应:_________________________________________________。
(2)试说明用熟石灰的悬浊液而不用澄清的石灰水的理由。_________________________。
(3)在英国进行的一项研究结果表明:高烟囱可有效地降低地表面SO2浓度,在20世纪60—70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,地表面SO2浓度却降低了30%之多。
请你从全球保护的角度,分析这种方法是否可取?简述理由:_________________________。
查看习题详情和答案>>已知氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s) ≒Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有二氧化硫、氧气、氮气、二氧化碳等。为了除去有害气体二氧化硫并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏[CaSO4·2H2O]。
(1)写出上述两个反应的化学方程式:①_____________;②_________________。
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:________。
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面二氧化硫的浓度。在二十世纪六七十年代的10年间,由发电厂排放出的二氧化硫增加了35%,但由于建造高烟囱的结果使地面二氧化硫的浓度降低了30%之多。请从全球环境保护的角度,分析这种方法是否可取?答____________________。
查看习题详情和答案>>▲已知氢氧化钙和碳酸钙在水中分别存在下列溶解平衡:Ca(OH)2(s)![]() Ca2++2OH-,CaCO3(s)
Ca2++2OH-,CaCO3(s)![]() Ca2++CO
Ca2++CO![]() 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:________________________________________;
②SO2与Ca(OH)2悬浊液反应:____________________________________。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
(3)在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在二十世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,地表面SO2浓度却降低了30%之多。
请你从全球环境保护的角度,分析这种方法是否可取?简述理由。
查看习题详情和答案>>