题目内容
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
NO2、SO2
NO2、SO2
能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.如:CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
0.3
0.3
mol,放出的热量为| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O).写出有关的化学反应方程式
SO2+Ca(OH)2=CaSO3↓+H2O、2CaSO3+O2+4H2O=2CaSO4?2H2O
SO2+Ca(OH)2=CaSO3↓+H2O、2CaSO3+O2+4H2O=2CaSO4?2H2O
.(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
| 催化剂 |
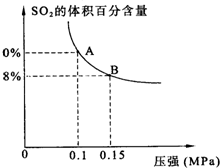
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系
释放
释放
(填“吸收”或“释放”)能量.②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于
32
32
.分析:(1)NO2、SO2是导致酸雨的主要气体.
标准状况下3.36升CO的物质的量为0.15mol,CO还原NO2至N2,自身被氧化为CO2,碳元素化合价由+2价升高为+4价,转移电子是CO的2倍.
根据盖斯定律第一个热化学方程式乘以2与第二热化学方程式相加构造出目标热化学方程式,据此计算;
(2)Ca(OH)2与SO2反应生成CaSO3,CaSO3在水中被氧化生成CaSO4?2H2O.
(3)①由图可知,平衡状态由A变到B时,增大压强,三氧化硫的体积分数增大,反应向生成三氧化硫的分析进行.
②利用三段式解题法计算平衡时各物质的平衡浓度,代入平衡常数k=
计算.
标准状况下3.36升CO的物质的量为0.15mol,CO还原NO2至N2,自身被氧化为CO2,碳元素化合价由+2价升高为+4价,转移电子是CO的2倍.
根据盖斯定律第一个热化学方程式乘以2与第二热化学方程式相加构造出目标热化学方程式,据此计算;
(2)Ca(OH)2与SO2反应生成CaSO3,CaSO3在水中被氧化生成CaSO4?2H2O.
(3)①由图可知,平衡状态由A变到B时,增大压强,三氧化硫的体积分数增大,反应向生成三氧化硫的分析进行.
②利用三段式解题法计算平衡时各物质的平衡浓度,代入平衡常数k=
| c2(SO3) |
| c2(SO2)?c(O2) |
解答:解:(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中NO2、SO2是导致酸雨的形成主要气体.
标准状况下的3.36L CO的物质的量为
=0.15mol,反应中CO还原NO2至N2,自身被氧化为CO2,碳元素化合价由+2价升高为+4价,所以转移电子的物质的量为0.15mol×(4-2)=0.3mol.
已知:①CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
②2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
由盖斯定律可知,①×2+②得到:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-(2a+b)kJ?mol-1.
所以0.15molCO反应放出的热量为
×(2a+b)kJ?mol-1=
kJ.
故答案为:NO2、SO2;0.3;
.
(2)Ca(OH)2与SO2反应生成CaSO3,CaSO3在水中被氧化生成CaSO4?2H2O,
有关反应方程式为:SO2+Ca(OH)2=CaSO3↓+H2O,2CaSO3+O2+4H2O=2CaSO4?2H2O.
故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;2CaSO3+O2+4H2O=2CaSO4?2H2O.
(3)2SO2(g)+O2(g)
2SO3(g)△H=-196.kJ?mol-1
①由图可知,平衡状态由A变到B时,增大压强,三氧化硫的体积分数增大,反应向生成三氧化硫的分析进行,反应体系释放能量.
故答案为:释放.
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.
2SO2(g)+O2(g)
2SO3(g)
开始(mol):5 7 0
变化(mol):2x x 2x
平衡(mol):5-2x 7-x 2x
所以
=10%,解得x=2
所以平衡时c(SO3)=
=0.4mol/L,c(SO2)=
=0.1mol/L,
c(O2)=
=0.5mol/L
所以平衡常数k=
=32
故答案为:32
标准状况下的3.36L CO的物质的量为
| 3.36L |
| 22.4L/mol |
已知:①CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
②2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
由盖斯定律可知,①×2+②得到:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-(2a+b)kJ?mol-1.
所以0.15molCO反应放出的热量为
| 0.15mol |
| 4 |
| 3(2a+b) |
| 80 |
故答案为:NO2、SO2;0.3;
| 3(2a+b) |
| 80 |
(2)Ca(OH)2与SO2反应生成CaSO3,CaSO3在水中被氧化生成CaSO4?2H2O,
有关反应方程式为:SO2+Ca(OH)2=CaSO3↓+H2O,2CaSO3+O2+4H2O=2CaSO4?2H2O.
故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;2CaSO3+O2+4H2O=2CaSO4?2H2O.
(3)2SO2(g)+O2(g)
| 催化剂 |
①由图可知,平衡状态由A变到B时,增大压强,三氧化硫的体积分数增大,反应向生成三氧化硫的分析进行,反应体系释放能量.
故答案为:释放.
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.
2SO2(g)+O2(g)
| 催化剂 |
开始(mol):5 7 0
变化(mol):2x x 2x
平衡(mol):5-2x 7-x 2x
所以
| 5-2x |
| 5-2x+7-x+2x |
所以平衡时c(SO3)=
| 2×2mol |
| 10L |
| 5mol-2×2mol |
| 10L |
c(O2)=
| 7mol-2mol |
| 10L |
所以平衡常数k=
| 0.42 |
| 0.12×0.5 |
故答案为:32
点评:看出反应热的计算、平衡计算、化学用语等,难度中等,(1)中计算反应热构造出目标热化学方程式是解题关键.

练习册系列答案
相关题目
 SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
 SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
 SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。