摘要:11.已知A.B.C三种元素均为短周期元素.它们的原子序数关系为C>B>A.A元素原子的最外层电子数是次外层电子数的2倍.B和C可形成BC4型化合物.用化学符号填空: (1)三种元素中A是 .B是 .C是 . (2)A.B.C的最高价氧化物对应的水化物分别是 . . .在这些水化物中.酸性最弱的是 . (3)用化学方程式说明A的最高价含氧酸的酸性比B的最高价含氧酸的酸性强 , (4)已知BC4不能在空气中燃烧.理由是 . (5)用离子方程式表示出用B的氧化物制得B的氧化物对应水化物的原理 . 解析:依据A的电子层结构特点.可知A为碳,B和C可形成BC4型化合物.可推知B为ⅣA族元素.C为ⅦA族元素.又因为原子序数的关系C>B>A.可知B为Si.C为氯.结合其他化合物的性质.可推知其他问题的答案. 答案:H2 CO3 H2SiO3 HClO4 H2SiO3 (3)CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3 (4)SiCl4在点燃的条件下不能被O2氧化 (5)SiO2+2OH-===SiO+H2O.SiO+CO2+H2O===H2SiO3↓+CO
网址:http://m.1010jiajiao.com/timu3_id_79250[举报]
已知A、B、C三种元素均为短周期元素,它们的原子序数关系为:A<B<C。A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物。用化学符号回答:
(1)A是________,B是________,C是________。
(2)它们的最高价氧化物对应的水化物分别是________,________,________,其中酸性最弱的________________。
(3)BC4的电子式是________________。
(4)用化学方程式表示如何用B的氧化物制取B的最高价氧化物对应的水化物是_______
________________________________。
查看习题详情和答案>>
已知A、B、C三种元素均为短周期元素,它们的原子序数关系为:C>B>A,A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物。用化学符号填空:
(1)三种元素中A是_______、B是_______、C是_______。
(2)A、B、C的最高价氧化物对应的水化物分别是_______、_______、_______,在这些水化物中,酸性最弱的是_______。
(3)BC4的电子式是_______。
(4)已知BC4不能在空气中燃烧,理由是_______。
(6)用离子方程式表示出用B的氧化物制得B的氧化物对应水化物的原理。
查看习题详情和答案>>
已知A、B、C三种元素均为短周期元素,它们的原子序数关系为:A<B<C。A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物。用化学符号回答:
(1)A是________,B是________,C是________。
(2)它们的最高价氧化物对应的水化物分别是________,________,________,其中酸性最弱的________________。
(3)BC4的电子式是________________。
(4)用化学方程式表示如何用B的氧化物制取B的最高价氧化物对应的水化物是_______
________________________________。
查看习题详情和答案>>
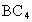 型化合物.用化学符号填空:
型化合物.用化学符号填空: