题目内容
已知A、B、C三种元素均为短周期元素,且它们的原子序数关系为:A<B<C.A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物.用化学符号回答:
(1)A是________,B是________,C是________.
(2)它们的最高价氧化物对应的水化物分别是(写化学式)________、________、________,其中酸性最弱的是(写化学式)________.
(3)BC4的电子式是________.
(4)用化学方程式表示如何用B的氧化物制取B的最高价氧化物对应的水化物________.
答案:
解析:
提示:
解析:
|
|
提示:
|
SiCl4分子的电子式中各原子的最外层上均满足8个电子的稳定结构. 由A元素的最外层电子数是次外层电子数的2倍,可知其次外层即为K层,K层上有2个电子,即A为碳元素.B、C形成BC4型化合物,由原子序数关系可确定B为硅元素,C为氯元素. |

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目

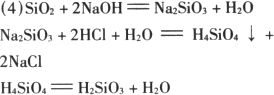
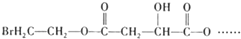
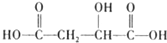

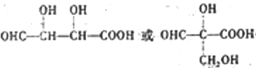
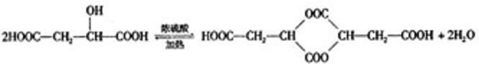
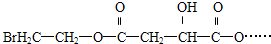
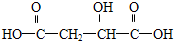 试回答:
试回答:
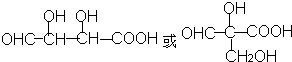
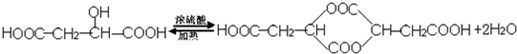
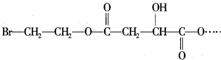
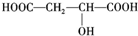

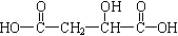 ,
,