摘要:6.物质的量浓度相同的下列溶液.pH由大到小排列正确的是( ) A.Ba(OH)2.Na2SO3.FeCl3.KCl B.Na2SiO3.Na2CO3.KNO3.NH4Cl C.NH3·H2O.H3PO4.Na2SO4.H2SO4 D.NaHCO3.C6H5COOH.C2H5OH.HCl 解析:A项.FeCl3水解使溶液呈酸性.比KCl溶液的pH小,C项.Na2SO4溶液呈中性.H3PO4为中强酸,D项.C6H5COOH溶液呈酸性.C2H5OH溶液呈中性. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_78876[举报]
(2011?甘肃二模)物质A~K都是由下表中离子组成的,且为中学化学常见物质,有下图所示的转化关系,部分产物中的水已省略.(如果需要阴、阳离子可以重复使用)

已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.试按要求回答下列相关问题:
(1)A、D、K、J的化学式为:A
(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是
(3)写出反应②的离子反应方程式
(4)用惰性电极电解I溶液阳极的电极反应式为
查看习题详情和答案>>
| 阳离子 | Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、SO2-4、AlO-2、NO-3 |

已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.试按要求回答下列相关问题:
(1)A、D、K、J的化学式为:A
Al2(SO4)3
Al2(SO4)3
、DBaSO4
BaSO4
、KNaNO3
NaNO3
、JAgCl
AgCl
;(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是
Ba(OH)2
Ba(OH)2
(用化学式表示);(3)写出反应②的离子反应方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(4)用惰性电极电解I溶液阳极的电极反应式为
4OH-+4e-=2H2O+O2↑
4OH-+4e-=2H2O+O2↑
.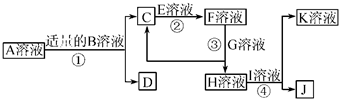 物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)
物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)| 阳离子 | Na+ Al3+ Ag+ Ba2+ | 阴离子 | OH- Cl- SO42- AlO2- NO3- |
(1)A、D、J的化学式为:A
(2)相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是
(3)写出反应③的离子方程式:
(4)用惰性电极电解Ⅰ溶液,阳极的电极反应式为:
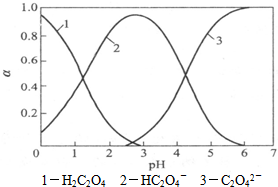 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:(1)试写出pH从3升至5的过程中反应的离子方程式:
HC2O4-+OH-=C2O42-+H2O
HC2O4-+OH-=C2O42-+H2O
(2)H2C2O4溶液中,c(H+)/c(C2O42-)
>
>
2(填“>”、“<”或“=”).(3)H2C2O4受热能分解,分解方程式为:
H2C2O4
CO↑+CO2↑+H2O
| ||
H2C2O4
CO↑+CO2↑+H2O
| ||
(4)H2C2O4是标定KMnO4溶液浓度常用的基准物质.标定KMnO4溶液浓度时,应将溶液加热至75~85℃,温度低于或高于该范围时都不利于滴定结果的准确,理由是_________.
(5)下表为物质的量浓度相同的几种酸对铁锈及锅炉水垢的溶解性的比较:
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
C
C
(填字母).A.酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好.