题目内容
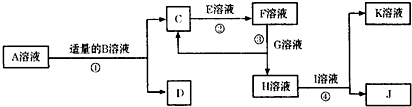
 物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)
物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)| 阳离子 | Na+ Al3+ Ag+ Ba2+ | 阴离子 | OH- Cl- SO42- AlO2- NO3- |
(1)A、D、J的化学式为:A
(2)相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是
(3)写出反应③的离子方程式:
(4)用惰性电极电解Ⅰ溶液,阳极的电极反应式为:
分析:已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.依据阳离子和阴离子组合可知,DJ为BaSO4,AgCl;C为Al(OH)3;A+B=C(Al(OH)3)+D,证明推断B为Ba(OH)2;A为Al2(SO4)3;D为BaSO4,J为AgCl;结合(2)中已知B溶液和E溶液都显碱性.C(Al(OH)3)+E=F,E为NaOH,F为NaAlO2,G溶液为酸或弱碱盐分析判断为AlCl3,H为NaCl,I为AgNO3,K为NaNO3,依据判断出的物质分析判断回答问题.
解答:解:通过题干中的信息和转化关系分析,离子中组合应有AgNO3,已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.依据阳离子和阴离子组合可知,D、J为BaSO4或AgCl;结合离子共存性质可知,C为Al(OH)3;A+B=C(Al(OH)3)+D,证明推断B为Ba(OH)2;A为Al2(SO4)3;D为BaSO4,J为AgCl;结合(2)中已知B溶液和E溶液都显碱性,C(Al(OH)3)+E=F,E为NaOH,F为NaAlO2,G溶液为弱碱强酸盐,分析判断G为AlCl3,H为NaCl,I为AgNO3,K为NaNO3;
(1)A、D、J的化学式为:A为Al2(SO4)3;D为BaSO4;J为AgCl;
故答案为:Al2(SO4)3;BaSO4;AgCl;
(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液为Ba(OH)2;E溶液为NaOH;pH较大的是:Ba(OH)2;故答案为:Ba(OH)2;
(3)反应③是F为NaAlO2和G为AlCl3反应生成氢氧化铝沉淀,反应的离子反应方程式:3AlO2-+Al3++6H2O═4Al(OH)3↓;
故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
(4)用惰性电极电解AgNO3溶液,阳极是氢氧根离子失电子生成氧气的电极反应,电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:4OH--4e-=2H2O+O2↑.
(1)A、D、J的化学式为:A为Al2(SO4)3;D为BaSO4;J为AgCl;
故答案为:Al2(SO4)3;BaSO4;AgCl;
(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液为Ba(OH)2;E溶液为NaOH;pH较大的是:Ba(OH)2;故答案为:Ba(OH)2;
(3)反应③是F为NaAlO2和G为AlCl3反应生成氢氧化铝沉淀,反应的离子反应方程式:3AlO2-+Al3++6H2O═4Al(OH)3↓;
故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
(4)用惰性电极电解AgNO3溶液,阳极是氢氧根离子失电子生成氧气的电极反应,电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:4OH--4e-=2H2O+O2↑.
点评:本题考查了物质转化关系的应用,物质性质的综合推断,离子共存的分析判断,物质转化的特征应用,依据离子反应的现象和特征反应判断,沉淀的判断是解题的关键,题目难度较大.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
物质A~K都是由下表中离子组成的,且为中学化学常见物质,有下图所示的转化关系,部分产物中的水已省略.(如果需要阴、阳离子可以重复使用)
| 阳离子 | Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、SO2-4、AlO-2、NO-3 |

已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.试按要求回答下列相关问题:
(1)A、D、K、J的化学式为:A______、D______、K______、J______;
(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是______(用化学式表示);
(3)写出反应②的离子反应方程式______;
(4)用惰性电极电解I溶液阳极的电极反应式为______.
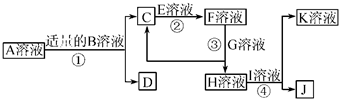
物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系。部分产物中的水已省略。(如果需要、阴、阳离子可以重复使用)
| 阳离子 | Na+ Al3+ Ag+ Ba2+ |
| 阴离子 | OH- Cl- SO42- AlO2- NO3- |

已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸。试按要求回答下列相关问题:
(1)A、D、J的化学式为:A________、D________、J________。
(2)相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是________(用化学式表示)。
(3)写出反应③的离子方程式:________。
(4)用惰性电极电解Ⅰ溶液,阳极的电极反应式为:________。