网址:http://m.1010jiajiao.com/timu3_id_78548[举报]
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
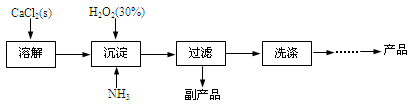
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
|
滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
0.3000 |
1.02 |
24.04 |
|
2 |
0.3000 |
2.00 |
25.03 |
|
3 |
0.3000 |
0.20 |
23.24 |
表1. KMnO4标准溶液滴定数据
查看习题详情和答案>>
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: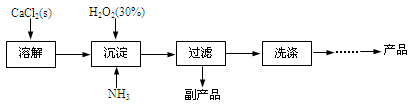
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
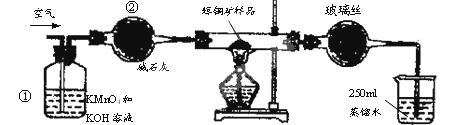
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。 查看习题详情和答案>>