摘要:17.有A.B.C.D.E五种元素.它们可能是原子或离子.且为短周期元素.A与B可形成BA型化合物.且A元素是非金属性最强的元素.金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,C元素有三种同位素C1.C2.C3.自然界里含量最多的是C1.C3原子的质量数是C1的3倍.C2原子的质量数是C1的2倍.D的气态氢化物水溶液显碱性.而其最高价氧化物的水化物为强酸.E元素原子的最外层电子数比次外层电子数多4个.E离子的核外电子数比质子数多2个. (1)写出A元素的名称: .C2粒子的符号: . (2)画出E离子的结构示意图: .E的氢化物的分子式 . (3)写出B的单质与E的单质化合的化学方程式: . (4)A与C形成的化合物中所含化学键的类型是 . [解析] 由A元素是非金属性最强的元素.可知其为氟元素.A与B可形成BA型化合物.可知B为钠元素,C元素有三种同位素C1.C2.C3.自然界里含量最多的是C1.C3原子的质量数是C1的3倍.C2原子的质量数是C1的2倍.可知C为氢元素,D的气态氢化物水溶液显碱性.而其最高价氧化物对应的水化物为强酸.可知D为氮元素,E元素原子的最外层电子数比次外层电子数多4个.可知其为氧元素. [答案] (1)氟 H (3)4Na+O2===2Na2O,2Na+O2Na2O2 (4)共价键
网址:http://m.1010jiajiao.com/timu3_id_77213[举报]
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1.试回答:
(1)写出基态D原子的电子排布式
(2)用电子式表示AE2的形成过程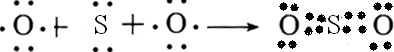
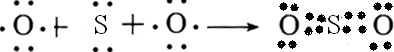 ,与AE2互为等电子体的离子是
,与AE2互为等电子体的离子是
(3)B、C两元素的第一电离能较大的元素是:
(4)根据VSEPR模型预测C的氢化物的立体结构为
(5)C的单质中π键的数目为
查看习题详情和答案>>
(1)写出基态D原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.(2)用电子式表示AE2的形成过程
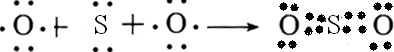
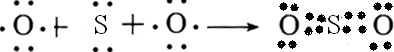
N3-(或CNO-)
N3-(或CNO-)
.(3)B、C两元素的第一电离能较大的元素是:
N
N
(填写元素符号).(4)根据VSEPR模型预测C的氢化物的立体结构为
三角锥形
三角锥形
,中心原子C的轨道杂化类型为sp3
sp3
.(5)C的单质中π键的数目为
2
2
,B、D两元素的气态氢化物的稳定性大小关系为:H2O
H2O
>SiH4
SiH4
(填写化学式).有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;
A原子核内仅有1个质子;B原子的电子总数与C原子的最外层电子数相等; C原子有两个电子层,最外层电子数是次外层电子数的3倍;D元素的最外层电子数是其电子层数的三分之一.E的单质是黄绿色气体且有毒.
(1)写出A分别与B、C所形成化合物的化学式:
(2)分别写出C和D的原子结构示意图:
 ,
,
 .
.
(3)写出C、D、E所形成的化合物的电离方程式:
(4)写出E的单质与A、C、D三元素所形成的化合物反应的化学方程式,若是氧化还原反应,请用双线桥标出电子转移的数目和方向:
 .
.
查看习题详情和答案>>
A原子核内仅有1个质子;B原子的电子总数与C原子的最外层电子数相等; C原子有两个电子层,最外层电子数是次外层电子数的3倍;D元素的最外层电子数是其电子层数的三分之一.E的单质是黄绿色气体且有毒.
(1)写出A分别与B、C所形成化合物的化学式:
CH4
CH4
,H2O
H2O
.(2)分别写出C和D的原子结构示意图:




(3)写出C、D、E所形成的化合物的电离方程式:
NaClO═Na++ClO-
NaClO═Na++ClO-
.(4)写出E的单质与A、C、D三元素所形成的化合物反应的化学方程式,若是氧化还原反应,请用双线桥标出电子转移的数目和方向:


有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级中的电子数等于次外层的电子总数,C原子最外层中有2个不成对的电子.已知C、D、E原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成RC2型化合物,在DC2中,D与C的质量比为7:8,在EC2中,E与C的质量比为1:1.请回答下列问题:
(1)写出A、E两种元素的元素符号:A
(2)写出D原子的电子排布式
(3)指出E在元素周期表中的位置
(4)比较A、B、C三种元素的第一电离能的大小顺序
(5)比较D和E元素的电负性的相对大小
查看习题详情和答案>>
(1)写出A、E两种元素的元素符号:A
C
C
、ES
S
.(2)写出D原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.(3)指出E在元素周期表中的位置
第三周期、第ⅥA族
第三周期、第ⅥA族
.(4)比较A、B、C三种元素的第一电离能的大小顺序
C<O<N
C<O<N
.(5)比较D和E元素的电负性的相对大小
Si<S
Si<S
.有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18,A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子有两个电子层,最外层电子数是次外层电子数的3倍,E元素原子最外层电子数是其电子层数的三分之一.
(1)画出E的原子结构示意图
 ;
;
(2)写出A与B、C、D所形成化合物的化学式:
查看习题详情和答案>>
(1)画出E的原子结构示意图


(2)写出A与B、C、D所形成化合物的化学式:
CH4
CH4
、NH3
NH3
、H2O
H2O
.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见的RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素分别是(用元素名称回答):D
(2)指出C元素在元素周期表中的位置
(3)沸点DB2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
“放”)
查看习题详情和答案>>
(1)推断五种元素分别是(用元素名称回答):D
硅
硅
,E硫
硫
.(2)指出C元素在元素周期表中的位置
第二周期第ⅤA族
第二周期第ⅤA族
.E元素的最高价氧化物的分子构型为平面三角形
平面三角形
.(3)沸点DB2
>
>
EB2(填“>”、“<”或“=”等于),理由SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
NO3-
NO3-
(填1种)(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
吸
吸
热(填“吸”或“放”)
236
236
kJ/mol| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |