摘要: 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: 依据上图.完成下列填空: (1)在电解过程中.与电源正极相连的电极上所发生反应的化学方程式为 .与电源负极相连的电极附近.溶液Ph (填“不变 .“升高 或“下降 ). (2)工业食盐含Ca2+.Mg2+等杂质,精制过程发生反应的离子方程式为 . (3)如果粗盐中SO42-含量较高.必须添加钡试剂除去SO42-.该钡试剂可以是 . a.Ba2 c.BaCl2 (4)在用隔膜法电解食盐水时.电解槽分隔为阳极室和阴极室.防止Cl2与NaOH反应.采用无隔膜电解冷的食盐水时.Cl2与NaOH充分接触.产物仅是NaClO和H2.相应 的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_76930[举报]
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下所示:

请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为
(2)粗盐中含Ca2+、Mg2+等杂质.精制过程中发生反应的离子方程式为
(3)为有效除去Ca2+、Mg2+和S
,加入试剂的合理顺序是
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3,
C.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(5)采用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学反应方程式为
查看习题详情和答案>>

请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,与电源负极相连的电极附近,溶液的pH升高
升高
(填“不变”、“升高”或“降低”).(2)粗盐中含Ca2+、Mg2+等杂质.精制过程中发生反应的离子方程式为
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
.(3)为有效除去Ca2+、Mg2+和S
| O | 2- 4 |
bc
bc
(填序号).a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3,
C.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
蒸发
蒸发
、冷却、过滤
过滤
(填操作名称)除去NaCl.(5)采用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学反应方程式为
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
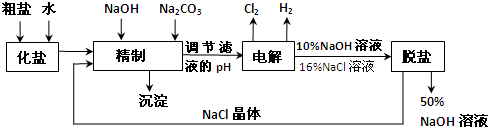
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 .
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 .
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序).
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: .
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 (填操作名称)而制得50%的NaOH溶液.
查看习题详情和答案>>

依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为
(3)精制过程要除去SO42-,可选择下列溶液中的
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、
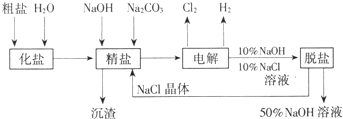 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:依据图,完成下列填空:
(1)电解饱和食盐水所发生的化学反应方程式为
(2)若对10L饱和食盐水电解两分钟共收集标准状况下的气体22.4L,电解后溶液的pH=
(3)为有效除去粗盐中含有的Ca2+、Mg2+、SO42-,加入试剂的合理顺序可以是
A.先加NaOH,后加Na2CO3,再加BaCl2,最后用盐酸酸化
B.先加NaOH,后加BaCl2,再加Na2CO3,最后用盐酸酸化
C.先加BaCl2,后加NaOH,再加Na2CO3,最后用盐酸酸化
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
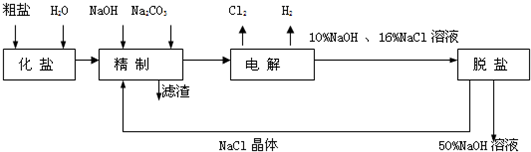
依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降),与电源正极相连的电极叫 极,检验该极上产物的方法是 .
(2)写出电解饱和食盐水的化学方程式 .
(3)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,
该钡试剂可以是 (选填a、b、c,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)判断钡试剂已经过量的方法是 .
(5)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a,b,c多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(6)为检验精盐纯度,需配制150mL0.2mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是 .
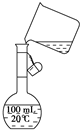 查看习题详情和答案>>
查看习题详情和答案>>

依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值
(2)写出电解饱和食盐水的化学方程式
(3)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,
该钡试剂可以是
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)判断钡试剂已经过量的方法是
(5)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(6)为检验精盐纯度,需配制150mL0.2mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是
 查看习题详情和答案>>
查看习题详情和答案>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为___________________。与电源负极相连的电极附近溶液Ph_________(填“不变”“升高”或“降低”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为______________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该试剂可以是_____________。
,该试剂可以是_____________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为___________(选a、b、c)。
,加入试剂的合理顺序为___________(选a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过___________、冷却、_________(填写操作名称)除去NaCl。
(6)在用阳离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,可防止Cl2与NaOH反应。采用无隔膜电解冷的食盐水时,Cl2与NaOH充分反应,产物最终仅有NaClO和H2,相应的化学反应方程式为___________________________、_______________________。
查看习题详情和答案>>