题目内容
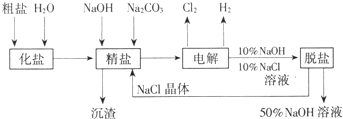 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:依据图,完成下列填空:
(1)电解饱和食盐水所发生的化学反应方程式为
(2)若对10L饱和食盐水电解两分钟共收集标准状况下的气体22.4L,电解后溶液的pH=
(3)为有效除去粗盐中含有的Ca2+、Mg2+、SO42-,加入试剂的合理顺序可以是
A.先加NaOH,后加Na2CO3,再加BaCl2,最后用盐酸酸化
B.先加NaOH,后加BaCl2,再加Na2CO3,最后用盐酸酸化
C.先加BaCl2,后加NaOH,再加Na2CO3,最后用盐酸酸化
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
分析:(1)电解饱和食盐水可以获得氢氧化钠、氯气和氢气;
(2)根据电解方程式结合生成氯气、氢气的量来计算生成氢氧化钠的物质的量,进而计算浓度以及pH即可;
(3)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(4)根据氯化钠的溶解度随温度变化不大的特征进行解答.
(2)根据电解方程式结合生成氯气、氢气的量来计算生成氢氧化钠的物质的量,进而计算浓度以及pH即可;
(3)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(4)根据氯化钠的溶解度随温度变化不大的特征进行解答.
解答:解:(1)电解饱和食盐水可以获得氢氧化钠、氯气和氢气,其方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)收集标准状况下的气体22.4L,即氯气和氢气各0.5mol,根据反应2NaCl+2H2O
2NaOH+H2↑+Cl2↑,生成氢氧化钠的物质的量是1mol,浓度是
=0.1mol/L,所以pH=13,故答案为:13;
(3)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,如果加反了,过量的钡离子就没法除去,故答案为:BC;
(4)由氯化钠的溶解度随温度变化不大的特征,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、过滤除去NaCl,故答案为:加热(蒸发);过滤.
| ||
| ||
(2)收集标准状况下的气体22.4L,即氯气和氢气各0.5mol,根据反应2NaCl+2H2O
| ||
| 1mol |
| 10L |
(3)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,如果加反了,过量的钡离子就没法除去,故答案为:BC;
(4)由氯化钠的溶解度随温度变化不大的特征,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、过滤除去NaCl,故答案为:加热(蒸发);过滤.
点评:本题涉及电解池的工作原理以及溶液pH的计算等方面知识,属于综合知识的考查,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
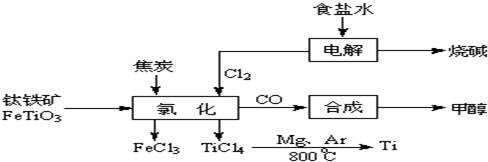
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是: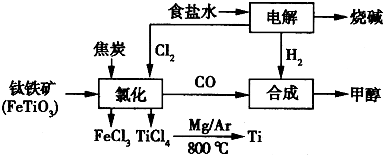
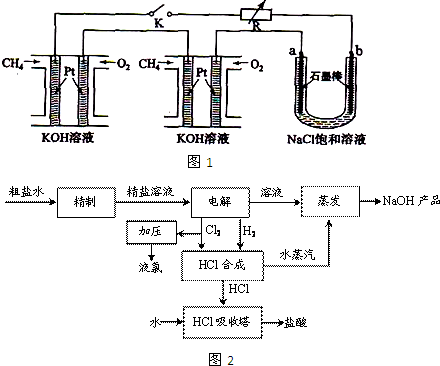



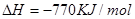
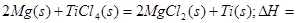 ____________
____________

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________