摘要: 常温.常压下.A.B.C.D均为气态.A和B可发生可逆反应A+BC+nD.若2 mol A和2 mol B混合充入体积可变的密闭容器中.在不同条件下达到平衡时C的浓度如下表: 温度/℃ 压强/Pa C平衡浓度/mol·L-1 25 1×105 1.0 25 2×105 1.8 25 4×105 3.2 25 5×105 6.0 (1)可逆反应中化学计量数n的取值范围是 .理由是 . (2)在5×105 Pa时.D的状态为 .
网址:http://m.1010jiajiao.com/timu3_id_76892[举报]
常温、常压下,A、B、C、D均为气态。A和B可发生可逆反应A+B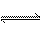 C+nD。若2 mol A和2 mol B混合充入容积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:
C+nD。若2 mol A和2 mol B混合充入容积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:
温度/℃ | 压强/Pa | C平衡浓度/mol·L-1 |
25 | 1×105 | 1.0 |
25 | 2×105 | 1.8 |
25 | 4×105 | 3.2 |
25 | 5×105 | 6.0 |
(1)可逆反应中化学计量数n的取值范围是___________________,理由是____________。
(2)在5×105 Pa时,D的状态为_____________________________________________。
查看习题详情和答案>>
常温、常压下,A、B、C、D均为气态。A和B可发生可逆反应A+B C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:?
C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:?
温度/℃ | 压强/Pa | C平衡浓度/mol·L-1 |
25 | 1×105 | 1.0 |
25 | 2×105 | 1.8 |
25 | 4×105 | 3.2 |
25 | 5×105 | 6.0 |
(1)可逆反应中化学计量数n的取值范围是_______,理由是______________。
(2)在5×105 Pa时,D的状态为____________________________。
查看习题详情和答案>>
常温、常压下,A、B、C、D均为气态。A和B可发生可逆反应A+B C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:
C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下表:
温度/℃ | 压强/Pa | C平衡浓度/mol·L-1 |
25 | 1×105 | 6.0 |
25 | 2×105 | 3.2 |
25 | 4×105 | 1.8 |
25 | 5×105 | 1.0 |
(1)可逆反应中化学计量数n的取值范围是____________,理由是____________________。
(2)在5×105 Pa时,D的状态为____________。
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.(1)C元素在周期表中的位置
第三周期、第 VIIA族
第三周期、第 VIIA族
.(2)A元素与水反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
Cl2+Na2S=2NaCl+S↓
Cl2+Na2S=2NaCl+S↓
.(4)BD2和C2均具有漂白性,二者的漂白原理
不同
不同
.(填“相同”或“不同”)(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2
 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1①当合成氨反应达到平衡后,改变某一外界条件 (不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是
加压
加压
,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3
t2-t3
.②温度为T℃时,将2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
A、B、C、D、E均为短周期元素,其中A是形成化合物最多的元素;常温常压下,B元素形成的单质是淡黄色固体,常在火山口附近沉积;C和B同周期,且C的电负性大于B;D元素在地壳中含量最多;E元素的单质在空气中含量最多.
(1)C位于元素周期表第
(2)A、B、C三种元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序是
(3)C的单质通入B的氢化物水溶液中,产生的实验现象是
(4)写出化合物AD2的电子式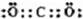
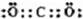 ,一种由D、E组成的化合物与AD2互为等电子体,其化学式为
,一种由D、E组成的化合物与AD2互为等电子体,其化学式为
查看习题详情和答案>>
(1)C位于元素周期表第
三
三
周期第ⅤⅡA
ⅤⅡA
族;合成E元素氢化物的工业反应化学方程式是H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(2)A、B、C三种元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序是
HClO4>H2SO4>H2CO3
HClO4>H2SO4>H2CO3
(用相应酸的分子式表示).(3)C的单质通入B的氢化物水溶液中,产生的实验现象是
乳白色沉淀
乳白色沉淀
,发生反应的化学方程式Cl2+H2S═2HCl+S↓
Cl2+H2S═2HCl+S↓
.(4)写出化合物AD2的电子式
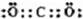
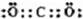
N2O
N2O
.