摘要: 已知Ba(AlO2)2可溶于水.下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( ) A. a-b时沉淀的物质的量:Al(OH)3比BaSO4多 B. c-d时溶液中离子的物质的量:AlO2-比Ba2+少 C. a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 D. d-e时溶液中离子的物质的量:Ba2+可能等于OH-
网址:http://m.1010jiajiao.com/timu3_id_76687[举报]
已知Cl 可溶于水,并发生如下反应:Cl
可溶于水,并发生如下反应:Cl +H
+H O==HCl+HClO。对此,下列说法错误的是( )
O==HCl+HClO。对此,下列说法错误的是( )
A.该反应是氧化还原反应
B.氯气(Cl![]() )是氧化剂,水(H
)是氧化剂,水(H![]() O)是还原剂
O)是还原剂
C.该反应不属于置换反应
D.Cl![]() 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
已知Cl![]() 可溶于水,并发生如下反应:Cl
可溶于水,并发生如下反应:Cl![]() +H
+H![]() O
O![]() HCl+HClO。对此,下列说法错误的是( )
HCl+HClO。对此,下列说法错误的是( )
A.该反应是氧化还原反应
B.氯气(Cl![]() )是氧化剂,水(H
)是氧化剂,水(H![]() O)是还原剂
O)是还原剂
C.该反应不属于置换反应
D.Cl![]() 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
①比较K1、K2的大小:K1
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.2v正(H2)=3v逆(NH3) b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①写出肼的电子式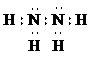
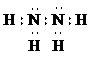 ,它属于
,它属于
②298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式
③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式
查看习题详情和答案>>
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
>
>
K2(填“>”、“=”或“<”).②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
acd
acd
(填序号).a.2v正(H2)=3v逆(NH3) b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率
不变
不变
(填“增大”、“减小”或“不变”);平衡向正反应
正反应
方向移动.④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)
>
>
Ksp(AgBr).(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①写出肼的电子式
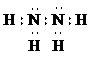
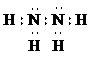
极
极
性分子.②298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol
.③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式
N2H4-4e-═N2+4H+
N2H4-4e-═N2+4H+
. (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳参与反应的化学方程式为
SO2+Ca(OH)2=CaSO3+H2O
SO2+Ca(OH)2=CaSO3+H2O
.②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有
控制适当的温度
控制适当的温度
、缓慢通入混合气体
缓慢通入混合气体
.
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
Mn2+催化氧气与亚硫酸反应生成硫酸
Mn2+催化氧气与亚硫酸反应生成硫酸
.(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①
边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7
边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7
;②过滤,用水洗涤2-3次
过滤,用水洗涤2-3次
;③检验SO42-是否被除去
检验SO42-是否被除去
;④用少量的乙醇洗涤
用少量的乙醇洗涤
;⑤低于100℃干燥.向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应(一取代);②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸.为探究哪种猜想正确,两研究性学习小组提出了如下两种实验方案:
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
① ② ③ .
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是 .
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸.
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 .
查看习题详情和答案>>
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
①
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=
若测得反应后n(Br-)=
若测得反应后n(Br-)=
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为