网址:http://m.1010jiajiao.com/timu3_id_75438[举报]

回答下列问题:
(1)混合物中是否存在FeCl2_______________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4____________(填“是”或“否”)。
(3)写出反应④的离子反应式:____________________________________。
(4)请根据计算判断混合物中是否含有AlCl3(简述你的计算依据和计算结果,不要求写完整计算过程)。
查看习题详情和答案>>某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
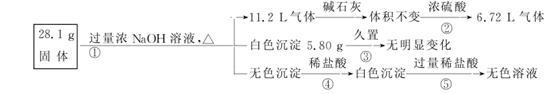
回答下列问题:
(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应④的离子方程式:________________________。
(4)请根据计算判断混合物中是否含有AlCl3(简述计算依据和计算结果,不要求写出完整的计算过程)。
查看习题详情和答案>>某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: __ 。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
查看习题详情和答案>>
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):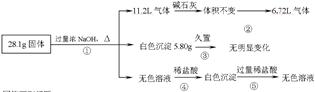
回答下列问题:
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: __ 。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
