网址:http://m.1010jiajiao.com/timu3_id_75406[举报]
50 mL密度为1.84 g·cm-3,质量分数为98%的浓H2SO4,其H2SO4的物质的量浓度为 。若将50 mL该浓H2SO4稀释成密度为1.47 g·cm-3的溶液100mL,需水 mL。( 水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
50 mL密度为1.84 g·cm-3,质量分数为98%的浓H2SO4,其H2SO4的物质的量浓度为 。若将50 mL该浓H2SO4稀释成密度为1.47 g·cm-3的溶液100mL,需水 mL。(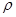 水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
查看习题详情和答案>>
用18.4 mol?L-1 的浓H2SO4配制100 mL浓度为1 mol?L-1的稀H2SO4, 其操作可分为以下各步:
A.用量筒量取______ mL浓H2SO4,缓缓注入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌;
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液转移入容量瓶里;
C.将稀释后的H2SO4溶液小心地转移到容量瓶里;
D.检查____mL容量瓶口是否发生滴漏;
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1~ 2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切.
据此填写: (1)填写以上空格.
(2)正确的操作顺序是(用字母填写) ______________________.
(3)进行A步操作时,应选择下列量器①10 mL量筒、②50 mL量筒、③100 mL量筒、④200 mL量筒中的(填序号) ___________.如果对装有浓H2SO4的量筒读数如右图所示读取,配制的稀H2SO4的浓度将(偏高、偏低、无影响) ____________.
![]()
(4)进行A步操作后,必须____________后,才能进行C步操作.
查看习题详情和答案>>用18.4 mol?L-1 的浓H2SO4配制100 mL浓度为1 mol?L-1的稀H2SO4, 其操作可分为以下各步:
A.用量筒量取______ mL浓H2SO4,缓缓注入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌;
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液转移入容量瓶里;
C.将稀释后的H2SO4溶液小心地转移到容量瓶里;
D.检查____mL容量瓶口是否发生滴漏;
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1~ 2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切.
据此填写: (1)填写以上空格.
(2)正确的操作顺序是(用字母填写) ______________________.
(3)进行A步操作时,应选择下列量器①10 mL量筒、②50 mL量筒、③100 mL量筒、④200 mL量筒中的(填序号) ___________.如果对装有浓H2SO4的量筒读数如右图所示读取,配制的稀H2SO4的浓度将(偏高、偏低、无影响) ____________.
![]()
(4)进行A步操作后,必须____________后,才能进行C步操作.
查看习题详情和答案>>①用量筒量取5.4 mL浓H2SO4,缓缓注入装有约50mL的蒸馏水的烧杯里并用玻璃棒搅拌。
②用约30 mL蒸馏水,分3次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶里。
③将稀释并冷却后的H2SO4小心地倒入容量瓶里。
④检查100 mL容量瓶口部是否会发生滴漏。
⑤将蒸馏水直接加人容量瓶,至液面接近刻度线0.5—l crrl处。
⑥盖紧瓶塞,后复颠倒振荡,摇匀溶液。
⑦用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和刻度线相切。
据此填写:
(1)正确的操作顺序是(用序号表示)______________。
(2)进行(1)步骤时,应选择下列容器中的(填序号)________。
a.10 mL量筒 b.50 mL量筒 c.500 mL量筒
d.1 000 mL量筒
如果对装有浓H2SO4的量筒读数时是仰视,配制的稀H2SO4的浓度将________ (“偏高”“偏低”或“无影响”)。
查看习题详情和答案>>