摘要:8.有a.b.c.d.e五种气体.进行下列实验: (1)a和b混合 气体变红棕色 (2)c和d混合 产生白烟 (3)c和e分别通入少量溴水中 溴水都变成无色透明的液体 (4)b和e分别通入氢硫酸中 都产生淡黄色浑浊 a.b.c.d.e依次可能是( ) A.O2.NO.HCl.NH3.CO2 B.O2.NO.NH3.HCl.SO3 C.NO.O2.NH3.HCl.SO2 D.HCl.CO2.NH3.H2S.CH4 解析:由a和b混合.气体变成红棕色.可知a和b为NO与O2的混合气,b通入氢硫酸中产生淡黄色沉淀.则b为氧气.a为NO,c和d混合产生白烟.则c和d为NH3.HCl的混合气,c通入少量溴水中溴水变成无色透明的液体.则c为NH3.d为HCl,e通入少量溴水中.溴水变成无色透明的液体.e通入氢硫酸中产生淡黄色浑浊.则e为SO2. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_75356[举报]
有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物;AC可与EB2反应生成A2B与气态物质EC4;E的M层电子数是K层电子数的2倍.
(1)画出E的原子结构示意图
 ;写出电子式D2B2
;写出电子式D2B2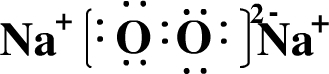
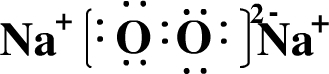 ;写出化学式EC4
;写出化学式EC4
(2)比较EB2与EC4的沸点高低(填化学式)
(3)用电子式表示化合物DC的形成过程
 .
.
查看习题详情和答案>>
(1)画出E的原子结构示意图


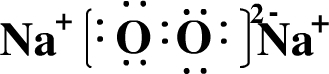
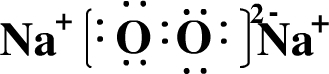
SiF4
SiF4
.(2)比较EB2与EC4的沸点高低(填化学式)
SiO2
SiO2
>SiF4
SiF4
.(3)用电子式表示化合物DC的形成过程


有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B
C+D↑(2)C+C A+E(3)D+E→B+C
A+E(3)D+E→B+C
由此可知它们的化学式分别为:
A
查看习题详情和答案>>
(1)A+B
| △ |
 A+E(3)D+E→B+C
A+E(3)D+E→B+C由此可知它们的化学式分别为:
A
OH-
OH-
,BNH4+
NH4+
,CH2O
H2O
,DNH3
NH3
,EH3O+
H3O+
.有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的价电子排布式图为 ;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
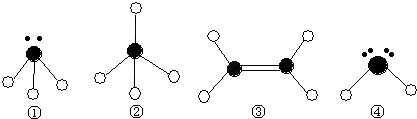
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键.
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;足量的C的氢化物水溶液与CuSO4 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况: .
查看习题详情和答案>>
(1)上述元素中,第一电离能最小的元素的原子结构示意图为
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
(5)D的氢化物分子中,D原子的杂化方式是
查看习题详情和答案>>
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
1:2
1:2
,F中既存在离子键又存在非极性
非极性
共价键(填“极性”或“非极性”).(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
HClO4
HClO4
>H2SO4
H2SO4
.(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
.(5)D的氢化物分子中,D原子的杂化方式是
sp3
sp3
,空间构型是V形
V形
.有A、B、C、D、E五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知A、C两种元素的质子数之和等于B的质子数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子比D元素的质子数多两个.据此填空:
(1)A在元素周期表中的位置为
(2)A的氢化物的结构式为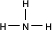
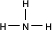 ,属于
,属于
(3)C的氢化物的电子式为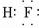
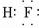 ,由电子式表示D和B所形成的化合物的过程
,由电子式表示D和B所形成的化合物的过程
 .
.
(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为
查看习题详情和答案>>
(1)A在元素周期表中的位置为
第二周期、第VA族
第二周期、第VA族
,A、B、C、D、E的单质中,氧化性最强的是F2
F2
(写化学式).(2)A的氢化物的结构式为
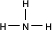
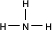
共价
共价
(填“共价”或“离子”)化合物.(3)C的氢化物的电子式为
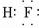
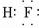


(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为
2OH-+Al2O3═2AlO2-+H2O
2OH-+Al2O3═2AlO2-+H2O
.
| A | C | |
| B |