摘要:17.(2009·山东省东营市胜利一中高三第一学期期中考试)将纯铁丝5.21克溶于过量的稀硫酸中.在加热下用2.53克KNO3去氧化溶液中的Fe2+.待反应完全后.剩余的Fe2+尚需12.0毫升0.3摩/升的KMnO4溶液才能刚好完全氧化(已知KMnO的还原产物是Mn2+).请确定NO的还原产物: ( ) A.N2O B.NO C.NO2 D.NH3 答案:C
网址:http://m.1010jiajiao.com/timu3_id_74732[举报]
将纯铁丝5.21g溶于过量的稀硫酸中,在加热条件下用2.53g KNO3去氧化溶液中的Fe2+,待反应完全后,剩余的Fe2+尚需12.0 mL 0.3 mol·L-1的KMnO4溶液方能完全氧化(已知 的还原产物是Mn2+),请确定
的还原产物是Mn2+),请确定 的还原产物
的还原产物
[ ]
A.N2O
B.NO
C.NO2
D.NH3
将纯铁丝5.21g溶于过量的稀H2SO4中,在加热下用2.53gKNO3氧化溶液中的Fe2+,待反应完全后,剩余的Fe2+还需要12.0mL0.3mol/L的KMnO4溶液方能完全氧化(已知Mn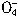 被还原为Mn2+),计算后确定N
被还原为Mn2+),计算后确定N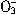 的还原产物为 ()。
的还原产物为 ()。
A.N2O B.NO C.NO2 D.NH3 查看习题详情和答案>>
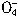 被还原为Mn2+),计算后确定N
被还原为Mn2+),计算后确定N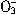 的还原产物为 ()。
的还原产物为 ()。A.N2O B.NO C.NO2 D.NH3 查看习题详情和答案>>
高纯硅是当今科技的核心材料.工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g)
Si(s)+4HCl(g).已知SiCl4可完全水解生成硅酸和盐酸.向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应.SiCl4的物质的量随时间变化情况如下表所示:
(1)T1时,反应开始的2min内,用HCl表示的反应速率为 .
(2)该反应的平衡常数表达式为:K= .
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 .
a.充入更多的SiCl4(g) b.充入更多的H2(g) c.及时分离出Si(s)
d.使用催化剂 e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1 T2(填“>”或“<”,下同),理由是 .
已知n1>n2,△H 0.
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率.该认识 (填“合理”或“不合理”),理由是 .
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到 .
查看习题详情和答案>>
| 高温 |
| 时间/min | 0 | 2 | 4 | t1 | t2 |
| n(SiCl4)/mol | |||||
| 温度/℃ | |||||
| T1 | 5.0 | 4.5 | 4.2 | n1 | n1 |
| T2 | 5.0 | 4.2 | 3.6 | n2 | n2 |
(2)该反应的平衡常数表达式为:K=
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是
a.充入更多的SiCl4(g) b.充入更多的H2(g) c.及时分离出Si(s)
d.使用催化剂 e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1
已知n1>n2,△H
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率.该认识
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到
某研究性学习小组进行了如下实验探究:将适量1.00mol?L-1 CuSO4溶液和2.00mol?L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2?CuSO4].将9.08g A隔绝空气在1000℃以上强热,得到了5.76g砖红色固体B(铜的+1价氧化物),同时得到的混合气体C;再将5.76g B溶于稀硫酸得到2.56g另一种红色固体D和蓝色溶液.(已知铜的化合价有+1和+2)
(1)实验需用1.00mol?L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需 ;所称取的胆矾固体是 克.
(2)甲同学认为A中含有杂质Na+,除去此杂质的方法是 .
(3)B与稀硫酸反应的离子方程式为 .
(4)通过计算确定A的组成为 .
查看习题详情和答案>>
(1)实验需用1.00mol?L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需
(2)甲同学认为A中含有杂质Na+,除去此杂质的方法是
(3)B与稀硫酸反应的离子方程式为
(4)通过计算确定A的组成为