题目内容
高纯硅是当今科技的核心材料.工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g)
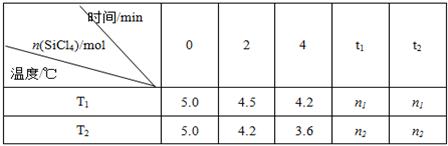
Si(s)+4HCl(g).已知SiCl4可完全水解生成硅酸和盐酸.向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应.SiCl4的物质的量随时间变化情况如下表所示:
(1)T1时,反应开始的2min内,用HCl表示的反应速率为 .
(2)该反应的平衡常数表达式为:K= .
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 .
a.充入更多的SiCl4(g) b.充入更多的H2(g) c.及时分离出Si(s)
d.使用催化剂 e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1 T2(填“>”或“<”,下同),理由是 .
已知n1>n2,△H 0.
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率.该认识 (填“合理”或“不合理”),理由是 .
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到 .
| 高温 |
| 时间/min | 0 | 2 | 4 | t1 | t2 |
| n(SiCl4)/mol | |||||
| 温度/℃ | |||||
| T1 | 5.0 | 4.5 | 4.2 | n1 | n1 |
| T2 | 5.0 | 4.2 | 3.6 | n2 | n2 |
(2)该反应的平衡常数表达式为:K=
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是
a.充入更多的SiCl4(g) b.充入更多的H2(g) c.及时分离出Si(s)
d.使用催化剂 e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1
已知n1>n2,△H
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率.该认识
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到
分析:(1)依据变化的物质的量之比等于化学计量数之比,然后根据v=
=
计算速率;
(2)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,注意固体.
(3)根据浓度、温度、压强对化学平衡的影响来分析;
(4)根据温度高化学反应速率快来判断;根据温度对化学平衡的影响;
(5)根据SiCl4遇水完全水解;
(6)一般情况下溶解度大的沉淀较易转化成溶解度小的沉淀;
| △c |
| △t |
| ||
| △t |
(2)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,注意固体.
(3)根据浓度、温度、压强对化学平衡的影响来分析;
(4)根据温度高化学反应速率快来判断;根据温度对化学平衡的影响;
(5)根据SiCl4遇水完全水解;
(6)一般情况下溶解度大的沉淀较易转化成溶解度小的沉淀;
解答:解:(1)T1时,反应开始的2min内,SiCl4的物质的量减少0.5mol,变化的物质的量之比等于化学计量数之比,所以生成氯化氢的物质的量为2mol,用HCl表示的反应速率为
=1.0 mol/(L?min);
故答案为:1.0 mol/(L?min);
(2)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,由于Si为固体,则平衡常数为
,
故答案为:
;
(3)a.充入更多的SiCl4(g),SiCl4(g)的浓度增大,平衡正向移动,氢气的转化率升高,但SiCl4(g)的转化率降低,故a错误;
b.充入更多的H2(g),H2(g)的浓度增大,平衡正向移动,SiCl4(g)的转化率升高,但H2(g)的转化率降低,故b正确;
c.及时分离出Si(s),由于硅是固体,浓度不变,平衡不移动,SiCl4(g)的转化率不变,故c错误;
d.使用催化剂,反应速率加快,但平衡不移动,SiCl4(g)的转化率不变,故c错误;
e.将容器的体积扩大一倍,即减小压强,平衡平衡正向移动,SiCl4(g)的转化率升高,故e正确;
故答案为:be;
(4)由表格可知,T2时速率快,则T1<T2,
由表格可知,在t1、t2时刻反应都到达平衡,n1>n2,说明温度越高,平衡正向移动,即△H>0,
故答案为:<;T2时反应速率快;>;
(5)SiCl4遇水完全水解生成硅酸和盐酸,所以不能采用水淋法来吸收生成的HCl,提高SiCl4的转化率;
故答案为:不合理;SiCl4遇水完全水解生成硅酸和盐酸;
(6)因氯化银的溶解度大于硫化银的溶解度,所以白色的氯化银沉淀可以转化为黑色的硫化银沉淀;
故答案为:白色沉淀可以转化为黑色沉淀;
| ||
| 2S |
故答案为:1.0 mol/(L?min);
(2)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,由于Si为固体,则平衡常数为
| C4(HCl) |
| C(SiCl4)C2(H2) |
故答案为:
| C4(HCl) |
| C(SiCl4)C2(H2) |
(3)a.充入更多的SiCl4(g),SiCl4(g)的浓度增大,平衡正向移动,氢气的转化率升高,但SiCl4(g)的转化率降低,故a错误;
b.充入更多的H2(g),H2(g)的浓度增大,平衡正向移动,SiCl4(g)的转化率升高,但H2(g)的转化率降低,故b正确;
c.及时分离出Si(s),由于硅是固体,浓度不变,平衡不移动,SiCl4(g)的转化率不变,故c错误;
d.使用催化剂,反应速率加快,但平衡不移动,SiCl4(g)的转化率不变,故c错误;
e.将容器的体积扩大一倍,即减小压强,平衡平衡正向移动,SiCl4(g)的转化率升高,故e正确;
故答案为:be;
(4)由表格可知,T2时速率快,则T1<T2,
由表格可知,在t1、t2时刻反应都到达平衡,n1>n2,说明温度越高,平衡正向移动,即△H>0,
故答案为:<;T2时反应速率快;>;
(5)SiCl4遇水完全水解生成硅酸和盐酸,所以不能采用水淋法来吸收生成的HCl,提高SiCl4的转化率;
故答案为:不合理;SiCl4遇水完全水解生成硅酸和盐酸;
(6)因氯化银的溶解度大于硫化银的溶解度,所以白色的氯化银沉淀可以转化为黑色的硫化银沉淀;
故答案为:白色沉淀可以转化为黑色沉淀;
点评:本题主要考查了化学反应速率的计算,化学平衡常数、外界条件对化学反应速率、化学平衡的影响以及沉淀的转化,难度不大,掌握反应的原理是解题的关键.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: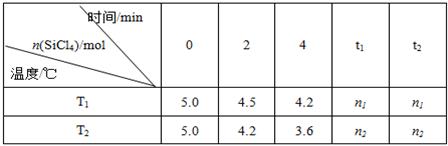
 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: